
| A. | FeS加入稀硫酸溶液中:FeS+2H+═Fe2++H2S↑ | |
| B. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 铜片跟浓硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O | |
| D. | 酸性KMnO4溶液中滴加H2O2:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O |
分析 A.二者反应生成硫酸亚铁和硫化氢;
B.二者反应生成碳酸钙、碳酸钠和水;
C.二者反应生成硝酸铜和二氧化氮;
D.二者反应生成锰离子、氧气和水,电荷不守恒.
解答 解:A.二者反应生成硫酸亚铁和硫化氢,离子方程式为FeS+2H+═Fe2++H2S↑,故A正确;
B.二者反应生成碳酸钙、碳酸钠和水,离子方程式为2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故B错误;
C.二者反应生成硝酸铜和二氧化氮,离子方程式为Cu+2NO3-+4H+═3Cu2++2NO2↑+2H2O,故C错误;
D.二者反应生成锰离子、氧气和水,离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的正误判断,明确发生的化学反应及离子反应的书写方法即可解答,离子方程式的书写要遵循电荷守恒、原子守恒、转移电子守恒,注意有些化学反应还与反应物的量有关,易错选项是B.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(HF)<c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(F-)-c(HF)=c(H+)-c(OH-) | D. | c(HF)+c(F-)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O2和Na2O | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
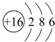 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 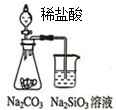 如图可能证明非金属性强弱:Cl>C>Si | |
| B. | 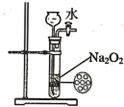 如图装置可用来制备少量氧气,并且控制反应的发生与停止 | |
| C. | 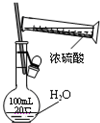 图中配制一定物质的量浓度的硫酸溶液不能直接在容量瓶中进行 | |
| D. | 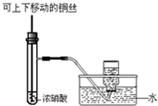 如图为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com