
| A. | ②④⑦⑧⑨⑩ | B. | ②④⑦⑨⑩ | C. | ③④⑦⑩ | D. | ④⑤⑦⑨⑩ |
分析 共价化合物分子中元素原子最外层电子数+|该元素化合价|(或共价键数目)=8,该元素原子满足8电子结构;
分子中若含有氢元素,则氢原子不能满足最外层8电子稳定结构,但它满足K层为最外层2个电子的稳定结构;
若为同种元素组成的分子,该元素原子的最外层电子数目与其在分子中形成的共价键的数目之和若为8,则其最外层满足8电子结构,反之不满足.
解答 解:①BeCl2分子Be原子最外层电子数为2+2=4,不满足8电子结构,故不选;
②NCl3分子中N原子形成3个N-Cl间,N原子最外层电子数为5+3=8,Cl原子最外层电子数=7+1=8,均满足8电子结构,故选;
③PCl5 分子中P原子最外层电子数为5+5=10,不满足8电子结构,故不选;
④COCl2 分子为C原子与氧原子之间形成C=O双键,C原子与Cl原子之间形成C-Cl,故C原子最外层电子数为4+4=8,Cl原子最外层电子数=7+1=8,O原子最外层电子数6+2=8,均满足8电子结构,故选;
⑤SF6 分子中S原子最外层电子数为6+6=12,不满足8电子结构,故不选;
⑥XeF2 分子中Xe原子本身最外层有8个电子,与F原子形成共价键,分子中最外层电子数大于8,故不选;
⑦CS2 分子中C原子最外层电子数为4+4=8,S原子最外层电子数=6+|-2|=8,均满足8电子结构,故选;
⑧CH4中H原子满足2电子结构,故不选;
⑨CF2Cl2分子中C原子与F、Cl原子之间形成C-F、C-Cl,C原子最外层电子数为4+4=8,Cl原子最外层电子数=7+1=8,F原子最外层电子数7+1=8,均满足8电子结构,故选;
⑩S2Cl2结构式为Cl-S-S-Cl,S原子最外层电子数为6+2=8,Cl原子最外层电子数=7+1=8,均满足8电子结构,故选,
故选:B.
点评 本题考查学生对共价键的理解,掌握8电子结构判断的方法,注意利用化合价(共价键数目)与最外层电子数来分析,难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg+2HCl═MgCl2+H2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | D. | CaCl2+Na2CO3═CaCO3↓+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol CO(g)+1/2O2(g)═CO2(g),△H=-283.0 kJ/mol C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 在0.1mol/L的氨水中加水稀释,氨水的导电能力降低 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯的制备实验中,用饱和氢氧化钠溶液来吸收随乙酸乙酯蒸出的少量乙酸和乙醇 | |
| B. | 甲烷跟氯气反应生成的CH3Cl、CH2Cl2、CHCl3、CCl4均为不溶于水的油状液体 | |
| C. | 石油的蒸馏,温度计的水银球必须插入反应液液面以下 | |
| D. | 水与金属钠反应比乙醇与金属钠反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | 2CH3CH2+O2$→_{△}^{Cu}$2ch3CHO+2H20 | |
| C. | ClCH2=CH2+NaOH$→_{△}^{水}$HOCH2CH=CH2+NaCl | |
| D. | 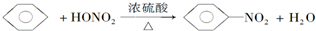 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.7 g | B. | 50 g | C. | 43 g | D. | 60 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质及变化 | 描述 | 相关知识 | |
| A | 瓦斯 | 混合物 | 主要成分为CO、H2 |
| B | 煤的干馏 | 物理变化 | 主要产品为焦炉气、煤焦油、粗氨水和焦炭 |
| C | 水煤气 | 混合物 | 一种高效的燃料 |
| D | 淀粉和纤维素 | 多糖 | 二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | M | Q | A | D | R | E | T |
| 原子半径/nm | 0.037 | 0.160 | 0.077 | 0.075 | 0.089 | 0.102 | 0.074 |
| 主要化 合价 | +1 | +2 | +4、+2 | +5、-3 | +2 | +6、-2 | -2 |
| A. | Q、R的单质与稀盐酸反应的剧烈程度Q<R | |
| B. | T、Q形成的简单离子核外电子数相同 | |
| C. | 化合物AM4、DM3、M2T的稳定性逐渐减弱 | |
| D. | 化合物M2T2、ET2均具有漂白性,且漂白原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com