
| A.C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H(298K)=-QkJ?mol-1 | ||||||
B.C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H(298K)=-
| ||||||
C.
| ||||||
| D.C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(l)△H(298K)=-2QkJ?mol-1 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:问答题
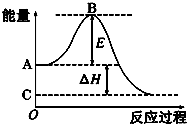
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
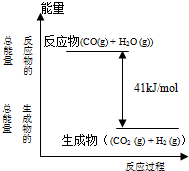
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2(g)+I2(s)→2HI(g)-26.5kJ |
| B.H2+I2→2HI-53kJ |
| C.H2(g)+I2(s)→2HI(g)-53kJ |
| D.0.5H2+0.5I2→HI-26.5kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
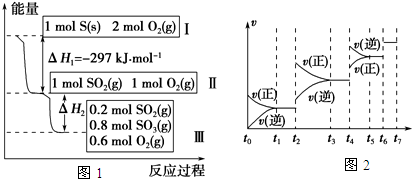
| t1-t2 | t3-t4 | t5-t6 | t6-t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应的熵变与反应的方向无关 |
| B.化学反应的熵变直接决定了反应的方向 |
| C.熵变为正的反应都是混乱度增大的反应 |
| D.能自发进行的反应熵变一定都为正 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.已知2SO2(g)+ O2(g) 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 |
| B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) ="l.0" × l0-a,该溶液的pH=7+0.5a |
| D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1AgNO3溶液,先生成Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应中熵变、焓变皆大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com