
(1)能源的开发利用与人类社会的可持续性发展息息相关。
已知:① Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H1=a kJ/mol
②CO(g)+1/2 O2(g)=CO2(g) △H2=b kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=c kJ/mol
则C的燃烧热____________________________kJ.mol-1
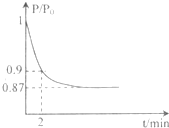
(2)某实验小组模拟工业合成氨反应N2+3H2 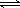 2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
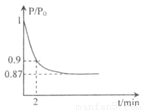
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3
△H =-92.4 kJ/mol,开始他们将N2和H2混合气体20mol
(体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
①反应达平衡的标志是(填字母代号)_____________
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为___________
③若提高N2的转化率可采取的措施有_______________
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol /L。
(1)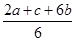 (2)①AC ② 0.1mol·L-1·min-1
③AB (3)2.5×10-3
(2)①AC ② 0.1mol·L-1·min-1
③AB (3)2.5×10-3
【解析】
试题分析:(1)(①×2+②×6+③)÷6可得
△H=(2△H1+6△H2+△H3)÷6=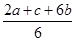 。(2)①A.反应是在体积固定的密闭容器中进行的。由于反应N2+3H2
。(2)①A.反应是在体积固定的密闭容器中进行的。由于反应N2+3H2  2NH3是一个反应前后气体的物质的量改变的化学反应。若压强不变,则气体的物质的量不变,反应达到平衡。正确。B. 由于容器的容积固定,无论反应是否达到平衡,气体的质量不变,气体密度也保持不变。错误。C.若NH3的生成速率是N2的生成速率的2倍,则每产生2个NH3,就会消耗1个N2。即N2生成速率与N2的生分解速率相等。正确。故选项为AC。③若提高N2的转化率,就要使化学平衡正向移动。A.向体系中按体积比1:1再充入N2和H2。即增大了体系的压强。增大压强化学平衡向正反应方向移动。反应物的转化率提高。正确。B.分离出NH3。减小生成物的浓度,化学平衡向向正反应方向移动,反应物的转化率提高。正确。C.由于该反应的正反应是一个气体体积减小的放热反应。升高温度化学平衡向吸热反应方向移动。所以升高温度化学平衡向逆反应方向移动,反应物的转化率降低。错误。D.充入He气使压强增大尽管压强增大,但未引起反应混合物的浓度发生改变,所以平衡不移动,N2的转化率不变。错误。E.加入一定量的N2。在其它条件不变的情况下,增大某反应物的浓度,可以使其它反应物的转化率提高,但它本身的转化率反而降低。错误。(3)c(CO32-)=0.2mol/L根据K(BaCO3)(sp)
2NH3是一个反应前后气体的物质的量改变的化学反应。若压强不变,则气体的物质的量不变,反应达到平衡。正确。B. 由于容器的容积固定,无论反应是否达到平衡,气体的质量不变,气体密度也保持不变。错误。C.若NH3的生成速率是N2的生成速率的2倍,则每产生2个NH3,就会消耗1个N2。即N2生成速率与N2的生分解速率相等。正确。故选项为AC。③若提高N2的转化率,就要使化学平衡正向移动。A.向体系中按体积比1:1再充入N2和H2。即增大了体系的压强。增大压强化学平衡向正反应方向移动。反应物的转化率提高。正确。B.分离出NH3。减小生成物的浓度,化学平衡向向正反应方向移动,反应物的转化率提高。正确。C.由于该反应的正反应是一个气体体积减小的放热反应。升高温度化学平衡向吸热反应方向移动。所以升高温度化学平衡向逆反应方向移动,反应物的转化率降低。错误。D.充入He气使压强增大尽管压强增大,但未引起反应混合物的浓度发生改变,所以平衡不移动,N2的转化率不变。错误。E.加入一定量的N2。在其它条件不变的情况下,增大某反应物的浓度,可以使其它反应物的转化率提高,但它本身的转化率反而降低。错误。(3)c(CO32-)=0.2mol/L根据K(BaCO3)(sp) CO32-
+Ba2+.C(CO32-)·C((Ba2+)=8×10-9.
C((Ba2+)=8×10-9÷0.2=4×10-8.
根据K(BaSO4)(sp)
CO32-
+Ba2+.C(CO32-)·C((Ba2+)=8×10-9.
C((Ba2+)=8×10-9÷0.2=4×10-8.
根据K(BaSO4)(sp) SO42-+
Ba2+. C(SO42-)·C((Ba2+)=1×10-10.
C(SO42-)=1×10-10÷C((Ba2+)=1×10-10÷4×10-8=2.5×10-3.
SO42-+
Ba2+. C(SO42-)·C((Ba2+)=1×10-10.
C(SO42-)=1×10-10÷C((Ba2+)=1×10-10÷4×10-8=2.5×10-3.
考点:考查盖斯定律的应用、外界条件对化学平衡的影响、反应物的转化率的影响及溶度积常数的有关计算的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.| 1 |
| 2 |
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省唐山市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)= 2Fe(s)+3CO(g) △H1=a kJ·mol-1
CO(g)+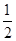 O2(g)=CO2(g)
△H2=b kJ·mol-1
O2(g)=CO2(g)
△H2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3=c kJ·mol-1
则C的燃烧热________kJ·mol-1
II.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是____(填序号)。
A.C(s)+CO2(g)=2CO(g) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l) = 2H2(g)+O2(g) D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:___________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g)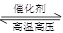 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中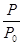 与时间t的关系如图所示。
与时间t的关系如图所示。
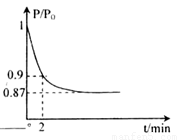
请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以c(N2)变化表示的平均反应速率为________。
③若提高N2的转化率可采取的措施有________。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2mol·L-1,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol • L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
近期大面积持续“油荒”、“电荒”,严重影响了生产、生活,能源成了亟待解决的问题。解决能源危机,除了政策调控外,新能源的开发利用才是根本的有效途径。
⑴直馏汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5~C11范围内,如戊烷,它有三种同分异构体,其沸点由高到低的顺序为 (用结构简式表示)。
⑵科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量。
即:H2(g)十1/2 O2(g)→H2O(l);△H=-285.5kJ/mol
但目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。请写出工业上由天然气和水蒸气反应制氢气的化学反应方程式。________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com