
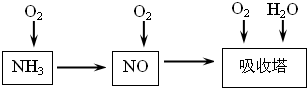
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为
;为了尽可能多地实现 向
向 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+ 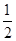 O2(g)=CO2(g)
△H=-283.0kJ·mol-1
O2(g)=CO2(g)
△H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
|
时间/s |
0 |
2 |
3 |
4 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
|
|
|
|
|
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
(1)4NH3+5O2 4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
(2)2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.0kJ·mol-1(2分)
①4.25×10-4mol/(L·s) (2分) ②5000(2分) ③CD(2分,各1分)
【解析】
试题分析:
本题是利用NH3制备HNO3一个工业上的应用。
(1)NH3的催化氧化反应方程式4NH3+5O2 4NO+6H2O,
4NO+6H2O,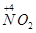 到
到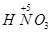 ,工业上是将NO2、过量O2通入H2O中,使得
,工业上是将NO2、过量O2通入H2O中,使得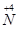 全被氧化又同时不产生污染性气体。
全被氧化又同时不产生污染性气体。
(2)根据盖斯定律将上式×2—下式即可得到2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.0kJ·mol-1
注意热化学方程式的书写规范
v(CO)= 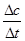 =4.25×10-4mol/(L·s) 注意单位书写
=4.25×10-4mol/(L·s) 注意单位书写
计算K的值,根据K的表达式:K=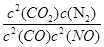 ,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为,
c(NO)= 1.00×10-4mol/L,c(CO2)=
9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为,
c(NO)= 1.00×10-4mol/L,c(CO2)=
9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
CD都可使平衡正向移动,反应物转化率增大,A和B选项平衡不移动,转化率不变
考点:化学平衡(化学反应速率,转化率,K的计算,盖斯定律)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以NH3为原料制HNO3,将m g NH3完全转化为HNO3,且将生成的HNO3全部溶解于反应生成的水中,此硝酸溶液的质量分数为( )
A.77.8%
B.50%
C.63.5%
D.98%
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省“江淮十校”协作体高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是( )
选项 叙述I 叙述II
A NH3溶于水,呈碱性 工业上以NH3为原料生产硝酸
B Fe3+具有氧化性 用KSCN溶液可以检验Fe3+
C NH4Cl受热分解成NH3、HCl 用加热法除去NaCl中的NH4Cl
D 氢氟酸是强酸 氢氟酸不能保存在玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com