
【题目】按要求计算、整理化简并填空:
(1)若20g密度为ρgcm﹣3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是____。
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数的值用NA表示,则:
①该气体所含原子总数为___个。
②该气体在标准状况下的体积为____L。
③该气体溶于1L水中(不考虑反应),形成的溶液密度为ρg/cm3,则该溶液的物质的量浓度为____molL-1。
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】I.可逆反应2Cl2(g)+2H2O(g)![]() 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率 ________;v正 ________________;
(2)保持容器体积不变,加入He,则HCl的物质的量 _______________________.
(3)保持容器压强不变,加入He,则O2的体积分数 ______________________;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度 ____________,相对分子质量 ______________________.
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJmol-1、286kJmol-1、726kJmol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+。对于该平衡,下列叙述正确的是
CH3COO-+H+。对于该平衡,下列叙述正确的是
A. 加入少量NaOH固体,平衡向正反应方向移动
B. 加水,平衡向逆反应方向移动
C. 滴加少量0.1mol/LHCl溶液,溶液中c(H+)减少
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A和G均为气体,其中A为黄绿色。C和D均为酸,其中C具有漂白性。E和I均为常见金属,其中I为紫红色。

⑴气体A所含元素在周期表中的位置是:______。D的电子式为______。
⑵写出反应①的离子方程式:______。
⑶写出反应④的化学方程式,并用单线桥表示电子转移的方向和数目:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为H2A===H++HA-,HA-![]() H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
H++A2-(25 ℃时Ka=1.0×10-2),下列有关说法中正确的是( )
A. H2A是弱酸
B. 稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大
C. 在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L
D. 若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)<0.12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是
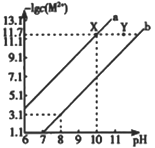
A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为___________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为__________________________________。
(3)比较下列各组热化学方程式中ΔH的大小关系。
4Al(s)+3O2(g) = 2Al2O3(s) ΔH1
4Fe(s)+3O2(g) = 2Fe2O3(s) ΔH2
ΔH1______ΔH2
(4)已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
若某反应的平衡常数表达式为K=[c(N2)·c2(CO2)]/[c2(CO)·c2(NO)],请写出此反应的热化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用作晒制蓝图。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为_________。
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→_____→尾气处理装置(仪器可重复使用)。
③实验前先通入一段时间N2,其目的为__________________。
④实验证明了气体产物中含有CO,依据的实验现象为_____________。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为____________________。
(3)晒制蓝图时,以K3[Fe(CN)6]溶液为显色剂,该反应的化学方程式为______________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为______________;步骤3中加入锌粉的目的为_______。
(5)草酸亚铁晶体样品的纯度为________;若步骤1配制溶液时部分Fe2+被氧化变质,则测定结果将____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列微粒的符号![]() 前20号元素
前20号元素![]() :
:
(1)最外层电子数是次外层电子数3倍的原子:______。
(2)最外层电子数等于次外层电子数的原子:_______。
(3)电子总数为最外层电子数2倍的原子:_______。
(4)内层电子总数是最外层电子数2倍的原子:______。
(5)得到2个电子后,电子总数与氩原子的电子总数相同的离子:_____。
(6)次外层电子数是最外层电子数2倍的原子:______。
(7)与氩原子电子层结构相同的+2价阳离子:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com