
具有下列电子层结构的原子,其第一电离能由大到小排列正确的是
①3p轨道上只有一对成对电子的原子;②外围电子构型为3s23p6的原子;
③其3p轨道为半满的原子;④正三价的阳离子结构与氖相同的原子。
| A.①②③④ | B.③①②④ | C.②③①④ | D.②④①③ |
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | HCl溶液中无OH﹣ |
|
| B. | NaOH溶液中无H+ |
|
| C. | KCl溶液中既无OH﹣也无H+ |
|
| D. | 常温下,任何物质的水溶液中都有H+和OH﹣,且Kw=1×10﹣14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知醋酸溶液中有如下平衡:CH3COOH⇌CH3COO﹣+H+,下列试剂能使CH3COOH的电离程度增大且c(H+)减小的是( )
|
| A. | CH3COOH | B. | H2O | C. | CH3COONa | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)肼燃料电池原理如图1所示,左边电极上发生的电极反应式为 .
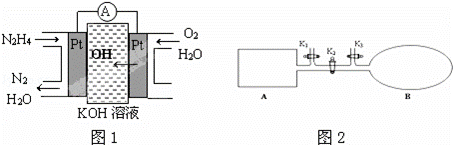
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJ•mol﹣1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJ•mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣52.7kJ•mol﹣1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: .
(3)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
①B中可通过 判断可逆反应2NO2⇌N2O4已经达到平衡.
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.14g聚丙烯中含C-H键总数目为2NA
B.1molFe与足量的稀硝酸反应转移电子总数目为2NA
C.标准状况下,44.8L乙醛中含乙醛分子总数目为2NA
D.常温常压下,200g质量分数为17%H2O2溶液中含氧原子总数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确的是
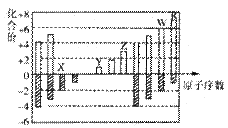
| A.原子半径比较: | B.气态氢化物的还原性比较:W>R |
| C.WX3和水反应形成的化合物是离子化合物 | D.含Z元素的盐溶液一定显示酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为
| A.(a+b)mol | B.(a-b)mol | C.(a-b)mol | D.(a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离可达到平衡:H2O⇌H++OH﹣△H>0,下列叙述正确的是( )
|
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH﹣)降低 |
|
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
|
| C. | 向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 |
|
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种有机物的结构简式如图,有关它的性质叙述,正确的是( )
①它有弱酸性,能与氢氧化钠反应;
②它不能发生水解反应;
③它能发生水解反应,水解后生成两种物质;
④它能发生水解反应,水解后只生成一种物质.
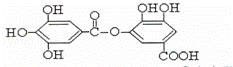
|
| A. | 只有① | B. | 只有①② | C. | 只有①③ | D. | 只有①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com