
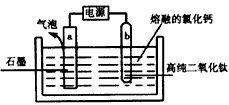
科目:高中化学 来源: 题型:阅读理解
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
| ||
| ||
| ||
| ||
查看答案和解析>>
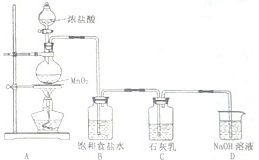
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
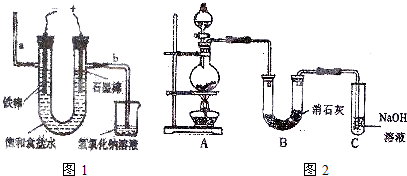
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2C12 | -77 | 137 | S2C12 遇水生成HCl、SO2、S,300℃以上完全分解; S2C12+C12
| ||||
| SCl2 | -121 | 59.6(分解) |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
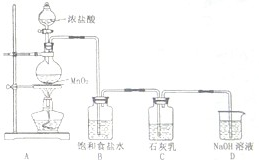
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com