
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路板的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:
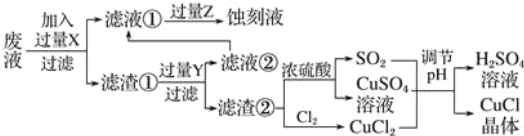
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X ,Y .
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是 ;生产过程中调节溶液的pH不能过大的原因是 ;
(3)写出产生CuCl的化学方程式: .
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是 .
【答案】(1)Fe;(2分)HCl;(2分)
(2)减少产品CuCl的损失;(2分)防止CuCl水解;(2分)
(3)CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;(2分)
(4)防止CuCl的氧化和见光分解(2分)
【解析】
试题分析:(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失。


科目:高中化学 来源: 题型:
【题目】加成反应也是有机化学中的一类重要的反应类型,下列各组物质中不能全部发生加成反应的是
A.乙烷、乙烯 B.乙烯、乙炔
C.氯乙烯、溴乙烯 D.顺-2-丁烯、反-2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学就在我们身边,它与我们的生活息息相关。
⑴ 请从①维生素C、②大理石、③明矾、④尿素[CO(NH2)2]中选择适当的物质填空(填序号):
常用的建筑材料是 ;常用的氮肥 。
常吃蔬菜水果可补充的物质是 ;农村用作絮凝剂来净化水是 。
(2)粒子的结构示意图为 它的电子数为 ,在化学反应中容易失去 个电子成为 (离子符号)
它的电子数为 ,在化学反应中容易失去 个电子成为 (离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态化合物X2Y4,常用作火箭燃料。32g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)![]() X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为22.4 L,其密度为1.25 g·L-1,则:
X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为22.4 L,其密度为1.25 g·L-1,则:
(1)反应前O2在标准状况的体积V(O2)约为________L;
(2)X2的摩尔质量为________________,Y元素的名称是______________;
(3)若反应生成0.1 mol X2,则生成Y2O的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要作用。
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置(填代表装置图的字母,下同);
分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置__________,该分离方法的名称为______________。
(2)从碘水中分离出I2,选择装置__________,该分离方法的名称为__________,若将碘水和CCl4混合,充分振荡并静置后,碘主要溶解在(填“上层”或“下层”)液体中,该层溶液颜色为__________。
(3)装置A中①的名称是__________。装置B在分液时为使液体顺利下滴,应进行的具体操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A.可用铝槽密闭盛装浓硫酸
B.工业上利用蛋白质的水解反应生产肥皂和甘油
C.乙醇可用作汽车燃料
D.食醋可用于消除暖水瓶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应:
2H2(g)+CO(g)![]() CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol·L-1,求:
CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol·L-1,求:
(1)以H2的浓度变化表示的该反应的速率。
(2)达到平衡时CO的转化率。
(3)该温度下的K。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国发射“神五”所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料。NO2为氧化剂,反应生成N2和水蒸气。已知:
①N2(g)+2O 2(g) = 2NO2(g) △H=+67.7kJ mol-1,
②N2H4(g)+O2(g) = N2(g)+ 2H2O(g) △H= -534 kJ mol-1。
下列关于肼和NO2反应的热化学方程式中正确的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7kJmol-1
B.2N2H4(g)+2NO2(g)=2N2(g)+4H2O(g)△H=-1135.7kJmol-1
C.N2H4(g)+NO2(g)=![]() N2(g)+2H2O(g)△H=-1135.7kJmol-1
N2(g)+2H2O(g)△H=-1135.7kJmol-1
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com