
分析 N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,反应中4mol的气体生成2mol氨气,气体的体积减少2mol积,据此计算.
解答 解:设生成的氨气为VmL,
N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$ 2NH3,△n
4mol 2mol 2mol
(110+130)mL VmL (110+130-220)mL
则 $\frac{2mol}{VmL}$=$\frac{2mol}{(110+130-220)mL}$,解得V=20mL;
答:生成氨气为20mL.
点评 本题考查了有关方程式的计算,题目难度不大,注意把握差量法在计算中的应用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图1装置除去HCl中少量的Cl2 | |
| B. |  用图2装置蒸干Al2(SO4)3饱和溶液制取无水Al2(SO4)3 | |
| C. |  图3制备并收集少量NO2 | |
| D. |  图4是原电池装置,Fe电极为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
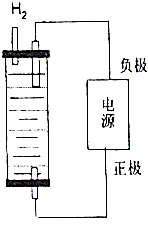 制取漂白粉的氯气通过电解饱和食盐水得到.
制取漂白粉的氯气通过电解饱和食盐水得到.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解、过滤的方法提纯含有少量碳酸镁的氢氧化镁 | |
| B. | 向混有乙酸的乙酸乙酯中加入NaOH溶液再分液提纯乙酸乙酯 | |
| C. | 除去FeCl2中少量的FeBr2:加入适量氯水,在加四氯化碳萃取、分液 | |
| D. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入NaHSO4溶液,沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55kJ | B. | 220kJ | C. | 550kJ | D. | 1108kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com