
 CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图: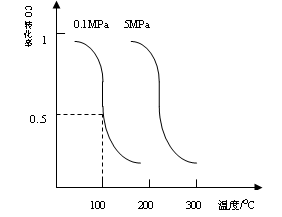
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
 CH3OH(g)
CH3OH(g)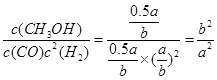
 CH3OH(g)
CH3OH(g)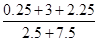 =0.55倍
=0.55倍

科目:高中化学 来源:不详 题型:单选题
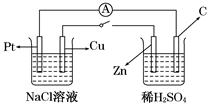
| A.Cu极附近OH-浓度增大 |
| B.Cu极为原电池负极 |
| C.电子流向是由C极流向Pt极 |
| D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Mg2+、Fe3+、NO3-、OH- | B.Al3+、Fe2+、Cl-、SO42- |
| C.K+、Na+、Cl-、HCO3- | D.Na+、Ba2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、Fe2+、AlO2-、NO3- | B.NH4+、Al3+、NO3-、SO42- | C.K+、NH4+、CO32-、S2- | D.Cu2+、Ag+、NO3-、CI- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.已知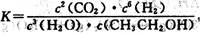 ,则对应的化学反应可以表示为: ,则对应的化学反应可以表示为:2CO2( g) + 6H2(g)  CH3CH2OH(g) + 3H2O(g) CH3CH2OH(g) + 3H2O(g) |
| B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大 |
| C.常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大 |
| D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入KSCN显红色的溶液中:Na+、Cu2+、Cl-、I- |
| B.c(CO32-)="0.1" mol/L的溶液中:K+、Na+、SO42-、OH- |
| C.c(H+)/c(OH-)=l012的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D.加入铝粉能产生大量氢气的溶液中:Na+、Ca2+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=2的溶液:Fe2+、NH4+、Cl—、NO3— |
B.能使pH试纸变深蓝色的溶液:Na+、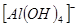 、S2—、CO32— 、S2—、CO32— |
| C.含有大量Fe3+的溶液:SCN—、I—、K+、Br— |
| D.澄清透明的无色溶液:ClO—、MnO4—、Al3+、SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+、NO3-、CO32-、Na+ | B.Na+、Ba2+、Cl-、SO42- |
C.NO3- 、K+、Cl-、Na+、OH- 、K+、Cl-、Na+、OH- | D.AlO2-、K+、OH-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com