
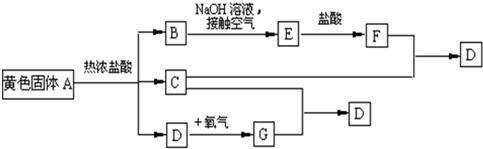


科目:高中化学 来源: 题型:阅读理解



| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下:
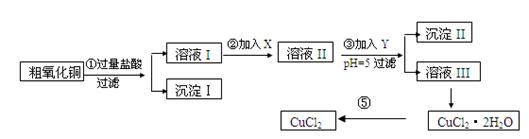
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
表Ⅱ
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | D | 氨水 |
| B | 高锰酸钾 | E | 碱式碳酸铜 |
| C | 氯水 | F | 氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂X可选用表Ⅱ中的 (填序号),其作用是 。
(3)步骤③加入的试剂Y可选用表Ⅱ中的 (填序号),控制pH=5的目的是 。
(4)步骤⑤要得到无水CuCl2,应控制的条件是 。
(5)步骤①中所发生的全部反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下:
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
表Ⅱ
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | D | 氨水 |
| B | 高锰酸钾 | E | 碱式碳酸铜 |
| C | 氯水 | F | 氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂X可选用表Ⅱ中的 (填序号),其作用是 。
(3)步骤③加入的试剂Y可选用表Ⅱ中的 (填序号),控制pH=5的目的是 。
(4)步骤⑤要得到无水CuCl2,应控制的条件是 。
(5)步骤①中所发生的全部反应的离子方程式:
。
查看答案和解析>>
科目:高中化学 来源:2010年河北省黄骅中学高二上学期期中考试化学试卷 题型:填空题
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下: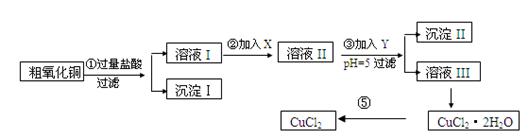
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | D | 氨水 |
| B | 高锰酸钾 | E | 碱式碳酸铜 |
| C | 氯水 | F | 氧化铜 |
查看答案和解析>>
科目:高中化学 来源:2010年河北省高二上学期期中考试化学试卷 题型:填空题
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下:
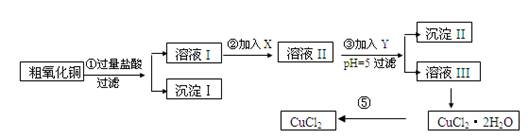
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
|
物质 |
开始沉淀时pH |
完全沉淀时pH[来源:Zxxk.Com] |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Cu(OH)2 |
5.2 |
6.4 |
表Ⅱ
|
氧化剂 |
调节pH的物质 |
||
|
A |
双氧水 |
D |
氨水 |
|
B |
高锰酸钾 |
E |
碱式碳酸铜 |
|
C |
氯水 |
F |
氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂X可选用表Ⅱ中的 (填序号),其作用是 。
(3)步骤③加入的试剂Y可选用表Ⅱ中的 (填序号),控制pH=5的目的是 。
(4)步骤⑤要得到无水CuCl2,应控制的条件是 。
(5)步骤①中所发生的全部反应的离子方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com