
(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式
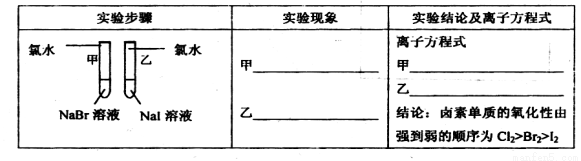
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理B. 部分合理C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是 。
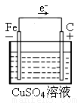
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
(1)①甲:溶液由无色变为橙色,离子方程式:Cl2+2Br-=2Cl-+Br2.乙:溶液 由无色变为黄色,离子方程式为:Cl2+2I-=2Cl-+I2。② B ;③ 溴水;(2)锌粉的表面积大,也能加快反应速率。(3)(图像3分)(正负极也可以用文字书写,正极材料、电解质溶液的选用合理即可。正负极材料、标正负极均正确给1分,电子移动方向正确给1分,电解质溶液正确给1分,若未形成闭合回路扣1分,即没画电解质或导线时。)负极:Zn - 2e-=Zn2+ 正极:Cu2+ + 2e-=Cu
【解析】
试题分析:(1)①由于非金属性Cl>Br>I,元素的非金属性越强,其单质的氧化性越强。活动性强的能把活动性弱的从化合物中置换出来。把氯气通入NaBr溶液中,氯气把溴单质置换出来,由于溴单质的水溶液为橙色。相应的离子方程式为Cl2+2Br-=2Cl-+Br2。把氯气通入NaI溶液中,氯气把碘单质置换出来,由于碘单质的水溶液为黄色。相应的离子方程式为Cl2+2I-=2Cl-+I2。②该方案只能证明Cl2>Br2,Cl2 >I2,但是不能证明Br2>I2,因此选项为B。③应该再补充一个实验,把溴水加入到NaI溶液中,若能发生置换反应,则证明Br2>I2。即Cl2>Br2 >I2。(2)Zn是固体,Zn粉的表面积比Zn块大,与同种浓度的盐酸接触面积大,实验反应速率快。而不是固体的浓度大引起的速率变化。(3)Zn、C作电极,电解质溶液为CuSO4,Zn、C连接起来同时插入CuSO4溶液。这时构成了原电池。Zn作负极,发生反应:Zn - 2e-=Zn2+。C为正极,在正极上发生反应:Cu2+ + 2e-=Cu。总方程式为Zn+Cu2+ =Cu+ Zn2+。
考点:考查同主族元素的性质递变规律、元素的金属性、非金属性强弱的比较的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
下列有关化学用语使用正确的是
A.NH4Br的电子式: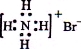 B.S2-的结构示意图:
B.S2-的结构示意图: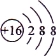
C.乙酸的分子式: CH3COOH D.原子核内有l8个中子的氯原子: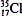
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
(4分)(2012?广东)下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:填空题
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
(1)B的分子式为C2H4O2,分子中只有一个官能团.则B的结构简式是 ,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是 ,该反应的类型是 ;写出两种能发生银镜反应的B的同分异构体的结构简式 .
(2)C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是 .
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是 .另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是 .
(4)A的结构简式是 .
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:选择题
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径.X元素为( )
A.Al B.P C.Ar D.K
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸……,下列有关氮化镓的说法中正确的是 ( )
A.氮化镓是由主族元素与副族元素形成的化合物 B.氮化镓能把白铁变成黄金
C.氮化镓中氮元素显+3价 D.氮原子最外层比镓原子最外层多2个电子
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
对反应A+2B = 4C+3D,以下化学反应速率的表示中,所表示反应速率最快的是 ( )
A.v (A)=0.40mol?L-1?s-1 B.v (B)=0.50mol?L-1?s-1
C.v (C)=0.36mol?L-1?s-1 D.v (D)=0.30mol?L-1?s-1
查看答案和解析>>
科目:高中化学 来源:2012-2013陕西省富平县高一下学期期末考试化学试卷(解析版) 题型:选择题
一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)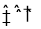 2NH3(g),能说明该反应达到化学平衡状态的是 ( )
2NH3(g),能说明该反应达到化学平衡状态的是 ( )
A.N2、H2、NH3的浓度相等
B.N2、H2、NH3的浓度不再变化
C.N2、H2、NH3在密闭容器中共存
D.反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高一上学期期中考试化学试卷(解析版) 题型:填空题
胶体是一种重要的分散系。
(1)制备Fe(OH)3胶体是向煮沸的蒸馏水中逐滴加入 溶液,继续煮沸至 ,停止加热。
(2)向Fe(OH)3胶体中加入某种溶液,出现沉淀,继续滴加该溶液后沉淀溶解。滴入的溶液可能是 。
A.NaOH溶液 B.稀H2SO4 C.Na2SO4溶液 D.乙醇溶液
(3)区分胶体和溶液常用的方法叫做 ,这是因为胶体粒子对光线的 作用而形成的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com