
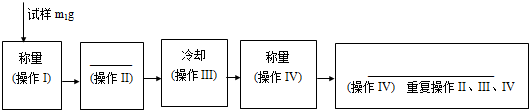
分析 (1)测定FeSO4•xH2O中结晶水含量的实验操作包括加热、冷却、称量、恒重;
(2)测定FeSO4•xH2O中结晶水含量的实验中必须在坩埚中加热;
(3)重复操作II、III、IV,直到连续两次称量结果相差不超过0.1g;
(4)实验需要称量固体的质量,操作III冷却为防止空气中的物质和其反应,应在干燥器中冷却;
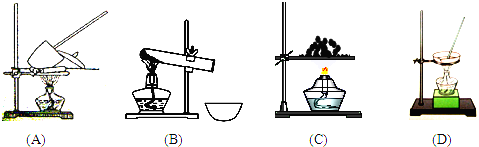
(5)A.加热时,晶体溅出坩埚,应重新做实验;
B.加热时,先用小火,后用大火加热,至恒重;
C.加热时,不断用玻璃棒搅拌,防止局部受热造成液体飞溅;
(6)A.晶体未完全变白就停止加热,导致结晶水未完全失去;
B.加热过程中有少量晶体溅出,会导致质量差值较大;
C.加热后在空气中自然冷却,会吸收空气中的水重新形成晶体,前后质量差减小.
解答 解:(1)测定FeSO4•xH2O中结晶水含量的实验操作包括加热、冷却、称量、恒重,恒重是为确保硫酸铜晶体完全失去结晶水,故答案为:加热;恒重;
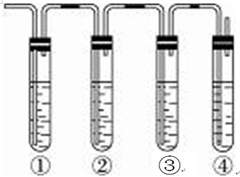
(2 )测定FeSO4•xH2O中结晶水含量的实验中必须在坩埚中加热,装置应选A,故答案为:A;
(3)重复操作II、III、IV,直到连续两次称量结果相差不超过0.001g,故答案为:0.001;
( 4)现有坩埚、研钵、三角架、泥三角、玻璃棒、干燥器、钥匙、酒精灯(火柴)、硫酸铜晶体样品等试验用品,还缺少的实验用品是天平,测定灼烧前后固体的质量;
操作III冷却必须要在干燥器中进行,故答案为:天平;干燥器;
(5)A.加热时,晶体溅出坩埚,应重新做实验,故A错误;
B.加热时,先用小火,后用大火加热,至恒重,故B错误;
C.加热时,不断用玻璃棒搅拌,防止局部受热造成液体飞溅,故C正确;
故答案为:C;
(6)A.加热时间过短而使硫酸铜晶体未完全变白,导致结晶水未完全失去,水的量偏小,则测定结果偏低;
B.加热过程中有少量晶体溅出,会导致质量差值较大,测得结晶水的值偏高;
C.加热后在空气中自然冷却,会吸收空气中的水重新形成晶体,反应前后质量差减小,结果偏低.
故答案为:B;AC.
点评 本题考查物质含量的测定实验,为高频考点,把握反应原理、实验仪器的使用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意结晶水含量的误差分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
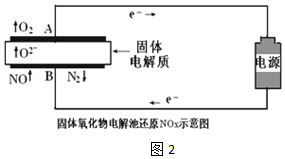
| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②⑤⑥⑧ | C. | ②③⑥⑧ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
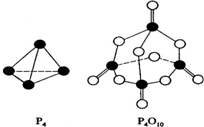 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com