
【题目】在一个容积为2L的密闭容器内进行如下反应:A2(g)+3B2(g)=aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。
请计算:
(1)a值_______。
(2)X的表示式(用A、B表示)_______。
(3)2min末A2的浓度________。
(4)B2的化学反应速率为_______。
(5)2min末B2的转化率为_______。
【答案】2 AB3 0.15 mol/L 0.9 mol/(L·min) 90%
【解析】
根据物质的量的变化比等于化学计量数之比求出a,根据反应前后各种元素的原子个数相等求出X的表示式,带入化学反应速率计算公式计算反应速率,2min末△c(A2)=![]() △c(B2)=
△c(B2)=![]() =0.6mol/L,根据化学反应速率的定义式计算V(A2),离子不同物质反应速率比等于化学计量数的比计算V(B2),利用物质的转化率等于
=0.6mol/L,根据化学反应速率的定义式计算V(A2),离子不同物质反应速率比等于化学计量数的比计算V(B2),利用物质的转化率等于![]() ×100%计算2min末B2的转化率。
×100%计算2min末B2的转化率。
(1)在2min内△n(B2)=4.0mol-0.4mol=3.6mol,△n(X)=2.4mol,根据物质的量的变化比等于化学计量数之比可知:△n(B2):△n(X)=3.6mol:2.4mol=3:2=3:a,所以a=2;
(2)根据质量守恒定律即反应前后各种元素的原子个数相等可知X的表达式为AB3;
(3)根据方程式中物质转化关系可知△n(A2):△n(B2)=1:3,△n(B2)=3.6mol,则△n(A2)=![]() △n(B2)=
△n(B2)=![]() △n(B2)=1.2mol,所以2min末A2的浓度c(A2)=
△n(B2)=1.2mol,所以2min末A2的浓度c(A2)=![]() =0.15mol/L;
=0.15mol/L;
(4)B2的化学反应速率为V(B2)=![]() =0.9 mol/(L·min);
=0.9 mol/(L·min);
(5)2min末B2的转化率为![]() ×100%=90%。
×100%=90%。


科目:高中化学 来源: 题型:
【题目】实验室要配制100mL 2mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管和__________。
(2)用电子天平称取氯化钠固体,其质量为____g。
(3)下列主要操作步骤的正确顺序是______(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F可用于制造香精,可利用下列路线合成。
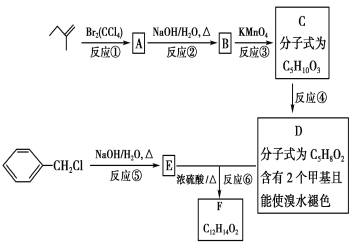
回答下列问题:
(1)![]() 分子中可能共面的原子最多有________个;
分子中可能共面的原子最多有________个;
(2)物质A的名称是__________________________________;
(3)物质D中含氧官能团的名称是_____________________________;
(4)“反应④”的反应类型是_____________________________________;
(5)写出“反应⑥”的化学方程式:______________________________________________;
(6)C有多种同分异构体,与C中所含有的官能团相同的有__________种,其中核磁共振氢谱为四组峰的结构简式为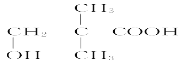 和______________________________。
和______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
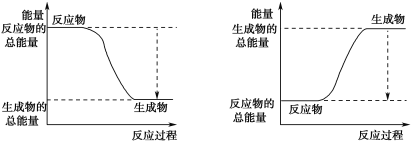
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
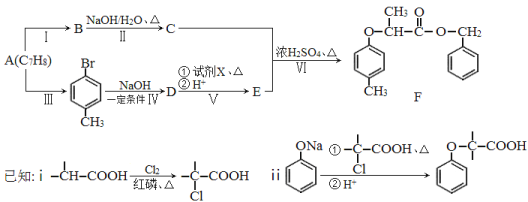
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取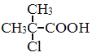 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能推出相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀 | AlO2-与HCO3-发生了相互促进的水解反应 |
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
C | 灼热的木炭加入浓硝酸中,放出红棕色气体 | 一定是木炭与浓硝酸反应生成了NO2 |
D | 将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | 说明制得的气体中含有乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有
A. Fe Mn Zn Mg B. Zn Cu Mg Ca
C. Zn Cu B Mn D. Mg Mn Cu Mo
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com