
氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
| A.制汽轮机 | B.制有色玻璃 |
| C.制永久性模具 | D.制造柴油机 |
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:填空题
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含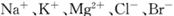 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F、G、H可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
请填空:
(1)写出E的两种用途 、 。
(2)反应②的离子方程式为 。
(3)反应③的化学方程式是 。
(4)反应④的离子方程式是 。
(5)写出一个由A生成H的置换反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是 ,该装置中发生反应的化学方程式为 。
(2)实验过程中,装置乙、丙中出现的现象分别是 ;装置丙中的试管内发生反应的离子方程式为 。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是 。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为 色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为 色。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化硅可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如下图所示:
其中-NH2中各元素的化合价与NH3相同。请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学反应方程式表示其原因: 。
(2)图示①~⑤的变化中,属于氧化还原反应的是 。(3)SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学反应方程式为 。
(4)在反应⑤中,3 mol Si(NH2)4,在高温下加热可得1 mol氮化硅粉末和8 mol A气体,则氮化硅的化学式为 。
(5)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是实验室制备气体的有关内容:
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制氧气 | H2O2―→O2 | |
| ② | 制氨气 | NH4Cl―→NH3 | |
| ③ | 是氯气 | HCl―→Cl2 | |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.下列做法正确的是____________。
| A.将浓硝酸保存在棕色玻璃瓶中 |
| B.用镊子取出白磷并置于水中切割 |
| C.把氯酸钾制氧气后的残渣倒入垃圾桶 |
| D.氢气还原氧化铜实验先加热再通氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是 ( )。
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变 红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com