
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
分析 Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小变为稀硫酸;
稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答 解:生成气体的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,溶液剩余硫酸的物质的量为:$\frac{1}{2}$×1L×0.1mol/L=0.05mol,参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气.
A.由以上计算可知,反应中共消耗1.8molH2SO4,故A正确;
B.气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,故B错误;
C.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,故C正确;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D正确;
故选B.
点评 本题考查方程式的相关计算,题目难度不大,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该题,计算生成气体的物质的量关系是解答该题的关键.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ① | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{39a}{18b+39a}×100%$ | B. | $\frac{1000ρa}{56a+18b}mol/L$ | ||
| C. | $\frac{a}{56a+18b}mol/L$ | D. | $\frac{56a}{56a+18b}%$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | CH3CH2CH2OH | C. | CH3CH(OH)CH3 | D. | (CH3)2CH(CH3)2COH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
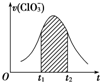 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.如图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| C. | 纵坐标为v(H+)的v-t曲线与图中曲线完全重合 | |
| D. | 图中阴影部分“面积”可以表示t1-t2时间为c(Cl-)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性由弱到强的顺序:M、N、Y | |
| B. | 单质Y的熔点高于单质Z的熔点 | |
| C. | 原子最外层电子数由少到多的顺序:Y、Z、X、M、N | |
| D. | 电解N和Z形成的化合物可得到对应的N和Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 滴入KI试液 | 检验淀粉是否已完全水解 |
| C | 先滴入Ba(NO3)2溶液.产生沉淀,加入足量稀盐酸,仍有沉淀 | 检验溶液中是否含有SO42- |
| D | 向乙醇溶液加入钠粒 | 测定乙醇分子中含有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com