
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题;

(1)④表示的元素是___(填元素符号);
(2)②、③两种元素相比较,原子半径较大的是___(填元素符号);
(3)写出①与⑥两种元素所形成化合物的化学式___;
(4)③和⑤两种元素的非金属性强弱顺序是③____⑤(填“<”或“>”)。
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】中国科学院大连化学物理研究所在碱性锌铁液流二次电池研究方面取得了新进展,其装置如图所示。下列说法不正确的是

A.充电时,电极X与电源负极相连
B.放电时,电极Y发生氧化反应
C.充电时,阳极的电极反应式为Fe(CN)64--e-=Fe(CN)63-
D.放电时,电路中通过1 mol电子,负极锌溶解的质量为32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为 CuFeS2。试回答下列问题:
(1)基态硫原子核外电子有_____种不同运动状态,能量最高的电子所占据的原子轨道形状为_________。
(2)基态Cu原子的价层电子排布式为_________;Cu、Zn的第二电离能大小I2(Cu) _________I2(Zn)(填“>”“<”或“=”)。
(3)SO2分子中S原子的轨道杂化类型为_________,分子空间构型为_________;与SO2互为等电子体的分子有_________(写一种)。
(4)请从结构角度解释H2SO3的酸性比H2SO4酸性弱的原因_________。
(5)Cu(CH3CN)4比四氨合铜离子稳定,其配离子中心原子配位数为_________,配位体中σ键与π键个数之比为_________。
(6)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间距离为anm。则该晶体的密度为_________g/cm3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
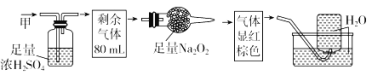
A. NH3、NO2、N2B. NH3、NO、CO2
C. NH3、NO2、CO2D. NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤④为过滤,步骤⑤蒸发结晶
D. 步骤③用 CuCO3代替CuO也可调节溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4![]() CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有___性。
(3)为了探究HClO的漂白性,某同学设计了如下的实验。
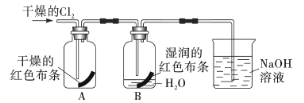
通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是___,从集气瓶B中湿润的红色布条的现象可得出的结论是___,其中发生的反应是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最新研制的利用氯化氢和氢气生产高纯硅的工艺流程如图所示:
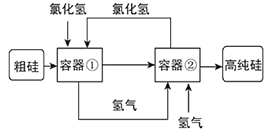
容器①中的反应为:Si(粗)+3HCl(g)=SiHCl3(l)+H2(g);容器②中进行的反应为:SiHCl3+H2=Si(纯)+3HCl,下列说法正确的是
A.反应①和②中HCl均作为氧化剂
B.该工艺流程的优点是部分反应物可循环使用
C.最好用分液的方法分离Si和SiHCl3
D.由反应①可知Si可与盐酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置(装置中的溶液为饱和食盐水),可用于简便环保地制备“84消毒液”,请注明直流电源的两极名称,并写出反应过程中涉及的化学反应方程式。

(1)a____________________b____________
(2)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为_____;基态Cu+的核外电子排布式为_____。
(2)化合物(CH3)3N分子中N原子杂化方式为_____,该物质能溶于水的原因是_____。
(3)PH3分子的键角小于NH3分子的原因是_____;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为_____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
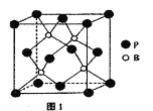
①在一个晶胞中磷原子的配位数为_____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com