
下列离子方程式中书写正确的一组是( )
① 向明矾溶液中加入Ba(OH)2溶液至A13+ 刚好完全沉淀:
Al3++ SO42-+3OH-+Ba2+= BaSO4↓+Al (OH)3↓
② 氟气和水反应:2F2+2H2O = 4H++4F-+O2
③ 向澄清石灰水中加入少量小苏打溶液:
Ca2++OH-+HCO3- = CaCO3↓+H2O
④ 铜片投入稀HNO3溶液:Cu+NO3-+4H+ = NO↑+2H2O+Cu2+
⑤ 钠与水反应:Na +2 H2O = Na+ +OH— + H2↑
⑥ 碳酸钙放入盐酸中: CO32- + 2H+ = CO2↑ +H2O
⑦ 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
⑧ 过量氯水与FeI2溶液作用: 2Fe2+ + 2I—+ 2Cl2 = 2 Fe3+ + I2 + 4Cl—
A. ①②③④ B. ③⑦ C. ①③④⑤ D.①④⑥⑦⑧
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
某实验需要使用大约480mL 1mol/L的稀H2SO4,现若要你用18.4mol/L的浓H2SO4配制,则你需量取浓H2SO4的体积是
A.26.1mL B.27.2mL C.26.0m L D.27.0mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:推断题
乙醇经下列步骤反应合成化合物C(分子式为C4H8O2),已知C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,反应路线如下:

(1)写出A.C结构简式:A , C ;
(2)写出x、y的反应类型:x 、y 。
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:填空题
I.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;
Ⅱ.25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:填空题
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
(1)A的化学式是 ,用电子式表示C的形成过程: 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由
查看答案和解析>>
科目:高中化学 来源:2016届宁夏中卫一中高三上学期期末理综化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
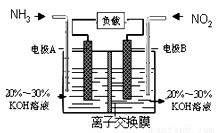
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电极A极反应式为:2NH3-6e-=N2+6H+
D.当有4.48L NO2(标准状况)被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:填空题
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
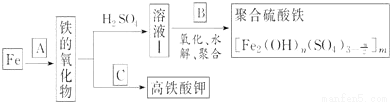
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol?L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 ; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g?L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末考试化学试卷(解析版) 题型:选择题
合金是一类用途广泛的金属材料。下列物质中,不属于合金的是 ( )
A.碳素钢 B.黄铜 C.硬铝 D.水银
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第四次摸底考试化学试卷(解析版) 题型:选择题
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中,一定能大量共存的是
A.a点对应的溶液中:Na+、OH-、SO42 -、NO3-
B.b点对应的溶液中:Al3+、Fe3+,MnO4- 、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3- 、Cl-
D.d点对应的溶液中:F-、NO3- 、Fe2+、Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com