
下列说法中正确的是
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
科目:高中化学 来源:2015届陕西省高二下学期期末考试化学试卷(解析版) 题型:填空题
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,
在催化剂作用下反应生成甲醇,
平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。
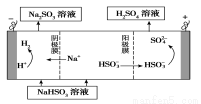
请写出开始时阳极反应的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高二上学期期中考试化学试卷(解析版) 题型:选择题
甲烷和丙烷混和气的密度与同温同压下一氧化碳的密度相同,混和气中甲烷和丙烷的体积比是
A.4:3 B.3:4 C.2:1 D.1:1
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:填空题
(22分)海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
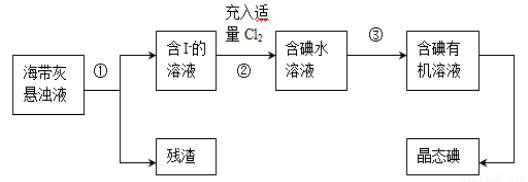
(1)灼烧海带时需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.蒸发皿 C.坩埚 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出上图中提取碘的过程中有关的实验操作名称:① ,③ 。
(3)操作③中所用的有机试剂可以是 (只填一种)。
(4)操作过程③可以分解为如下几步:
A、把盛有溶液的分液漏斗放在铁架台的铁圈中;
B、把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C、检验分液漏斗活塞和上口的玻璃塞是否漏液;
D、倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E、旋开活塞,用烧杯接收溶液;
F、从分液漏斗上口倒出上层液体;
G、将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H、静置、分层。
(a)过程③正确操作步骤的顺序是:(填编号字母) ;
(b)上述G步操作的目的是: ;
(c)最后碘的有机溶液是通过 获得(填“漏斗上口”或“漏斗下口”)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
(6)从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察下图所示实验装置指出其错误之处 、 。
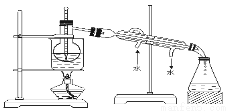
(7)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列十二种物质中:Fe、 CaO、SO3、盐酸、硫酸、KOH溶液、NH4HCO3、CCl4、NH3·H2O 、HF、BaSO4、熔融的KCl. 其中属于强电解质、弱电解质、非电解质的物质种类依次为:
A.5、2、2 B.7、3、2 C.6、2、4 D.5、3、4
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
在同温、同压下,A容器的氨气和B容器的氯气中,若它们所含的原子数相等,则这两个容器的体积之比是
A.2∶1 B.1∶2 C.2∶3 D.1∶3
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:填空题
(13分)1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
可能大量含有的阴离子 | Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。
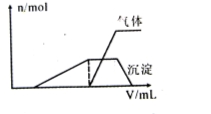
则该溶液中确定含有的离子有 ;
不能确定是否含有的阳离子有 ,
要确定其存在可补充做的实验是 ;
肯定不存在的阴离子有 。
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
n (Cl-) | 1.25mol | 1.5mol | 2mol |
n (Br-) | 1.5mol | 1.4mol | 0.9mol |
n(I-) | amol | 0 | 0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ;
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 ;
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是 ( )
A.Cs显+3价,I 、Cl 均显-1价
B.Cs显 +1价,Cl显+1价,I显-1价、
C.在CsICl2溶液中通入Cl2 ,有单质碘生成
D.在CsICl2溶液中通入SO2气体,有硫酸生成
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:选择题
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com