
【题目】主族元素W、X、Y、Z、Q在元素周期表中的相对位置如表所示,其中短周期元素W、X、Y、Z元素的原子最外层电子层电子数之和为21。下列说法不正确的是
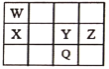
A.原子半径大小:X>Y>Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.最高价氧化物对应水化物的酸性:W>X>Y>Z
D.X、Q两种元素的单质能应用于半导体工业
【答案】C
【解析】
设Y元素的最外层电子数为x,那么W、X的最外层电子数为x-2,Z的最外层电子数为x+1,W、X、Y、Z元素的原子最外层电子层电子数之和为21,可得x-2+x-2+x+x+1=21,计算得x=6,故W为C,X为Si,Y为S,Z为Cl,Q为Se,据此判断。
设Y元素的最外层电子数为x,那么W、X的最外层电子数为x-2,Z的最外层电子数为x+1,W、X、Y、Z元素的原子最外层电子层电子数之和为21,可得x-2+x-2+x+x+1=21,计算得x=6,故W为C,X为Si,Y为S,Z为Cl,Q为Se;
A.同周期从左向右原子半径逐渐减小,A项正确;
B. W为C,能形成CO2,Y为S,能形成SO2,B项正确;
C. W的最高价氧化物对应水化物为H2CO3,X的最高价氧化物对应水化物为H2SiO3,Y的最高价氧化物对应水化物为H2SO4,Z的最高价氧化物对应水化物为HClO4,酸性强弱顺序为HClO4> H2SO4> H2CO3> H2SiO3,C项错误;
D. 硅、硒两种元素的单质均可用于半导体工业,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】头孢拉定又名先锋霉素,是常用的一种抗生素,其结构简式如图:
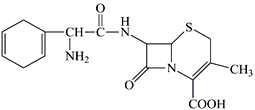
下列说法不正确的是( )
A. 头孢拉定的分子式是C16H19N3O4S,分子中有多种官能团
B. 头孢拉定与Na2CO3溶液、NaHCO3溶液都可以反应
C. 1mol头孢拉定最多可与6molH2和5mol Br2发生加成反应
D. 头孢拉定既可与盐酸反应,也可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以白云石(主要含CaCO3)为原料,按以下工艺流程制备某种新型的超导材料12CaO·7Al2O3。
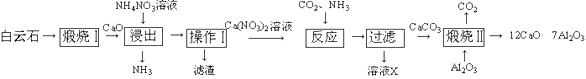
(1)若在实验室中进行“煅烧Ⅰ”的操作,可将样品放在_____________(填仪器名称)中加热;操作Ⅰ的名称是_____________。
(2)“浸出”过程中,CaO先与水反应生成Ca(OH)2,写出Ca(OH)2与NH4NO3溶液反应的化学方程式:_____________;检验“浸出”过程中有NH3生成的方法是___________。
(3)溶液X在流程中能循环利用,其中所含主要溶质的化学式为______。
(4)“煅烧Ⅱ”时发生反应为:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑。能否直接用白云石进行此步反应?请说明理由_____。
12CaO·7Al2O3+12CO2↑。能否直接用白云石进行此步反应?请说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24L水中含有0.1NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.02×1023
③2molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有NA个氯原子
A.①③④⑥⑧B.①④⑤C.①②⑤D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空.
(1)等质量的SO2和SO3所含氧原子个数之比__________
(2)4.8gCH4中所含氢原子个数与____________g水所含氢原子数相等
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为_____________,R的相对原子质量是_________
(4)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体的密度相对氢气为________,一氧化碳和二氧化碳的物质的量之比为___________,若将此混合气体通入足量的澄清石灰水中,生成的沉淀的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的 ( )
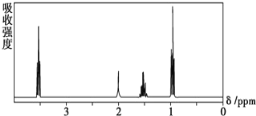
A.CH3CH2CH2CH3B.(CH3)3CCH3
C.CH3CH2CH2OHD.CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
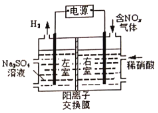
①写出电解时NO2发生反应的电极反应式:________。
②若有标准状况下2.24L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为___mol。
Ⅱ.汽车尾气是造成雾霾天气的重要原因之一,已知汽车尾气排放时容易发生以下反应:①![]() △H1=+180kJ·mol-1,②
△H1=+180kJ·mol-1,②![]() △H2,③
△H2,③![]() △H3,已知:CO和O2反应相关的化学键键能键能数据如下:
△H3,已知:CO和O2反应相关的化学键键能键能数据如下:

(1)在汽车上安装三元催化转化器可实现反应③,则该反应在________(填高温、低温或任何温度)下能自发进行。
(2)为研究温度、催化剂负载量和不同催化剂对NO去除率的影响。将NO和CO以一定的流速通过不同的催化剂进行反应经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),图1是不同负载量的Cu2+实验结果,图2是不同催化剂的实验结果(催化剂①指3%Co2+,催化剂②指3%Cu2+)。
图1 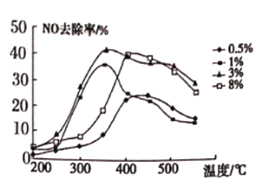 图2
图2 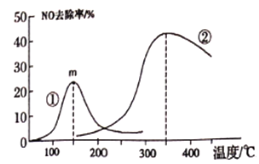
下列说法不正确的是________
A. 图1说明Cu2+含量越高脱氮效果越好
B. 图1说明Cu2+3%的催化剂在350℃左右脱氮效率最高
C. 图2说明第②种催化剂比第①种催化剂脱氮率高
D. 图2说明m点是平衡点
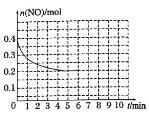
(3)在某温度下,2L密闭容器中充入NO、CO各0.4mol进行反应③,测得NO物质的量变化如图所示,5分钟末反应达到平衡,该反应的平衡常数K=____。第6分钟继续加入0.2mol NO、0.2mol CO、0.2mol CO2和0.3mol N2,请在右图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常教的值,下列说法不正确的是( )
为阿伏加德罗常教的值,下列说法不正确的是( )
A.4.0g![]() 中所含电子数为2
中所含电子数为2![]()
B.反应![]() 中,每生成3mol
中,每生成3mol![]() 转移的电子数为6
转移的电子数为6![]()
C.1mol![]() 分子中含单键的数目为
分子中含单键的数目为![]()
D.50mL![]() 浓
浓![]() 与足量铜反应,能收集到
与足量铜反应,能收集到![]() 的分子数目小于0.45
的分子数目小于0.45![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com