
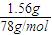 =0.02mol,氢氧化铝中n(OH-)=0.06mol,60mL 1mol?L-1的NaOH溶液中n(NaOH)=0.06L×1mol?L-1=0.06mol,60mL3mol?L-1的NaOH溶液中n(NaOH)=0.06L×3mol?L-1=0.18mol,根据氢氧根的物质的量可知,加到60mL1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,氯化铝有剩余,加到60mL3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此来计算解答.
=0.02mol,氢氧化铝中n(OH-)=0.06mol,60mL 1mol?L-1的NaOH溶液中n(NaOH)=0.06L×1mol?L-1=0.06mol,60mL3mol?L-1的NaOH溶液中n(NaOH)=0.06L×3mol?L-1=0.18mol,根据氢氧根的物质的量可知,加到60mL1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,氯化铝有剩余,加到60mL3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,以此来计算解答.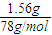 =0.02mol,氢氧化铝中n(OH-)=0.06mol,60mL 1mol?L-1的NaOH溶液中n(NaOH)=0.06L×1mol?L-1=0.06mol,60mL3mol?L-1的NaOH溶液中n(NaOH)=0.06L×3mol?L-1=0.18mol,根据氢氧根的物质的量可知,加到60mL1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,加到60mL3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
=0.02mol,氢氧化铝中n(OH-)=0.06mol,60mL 1mol?L-1的NaOH溶液中n(NaOH)=0.06L×1mol?L-1=0.06mol,60mL3mol?L-1的NaOH溶液中n(NaOH)=0.06L×3mol?L-1=0.18mol,根据氢氧根的物质的量可知,加到60mL1mol/LNaOH溶液中只发生Al3++3OH-═Al(OH)3↓,加到60mL3mol/LNaOH溶液中发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.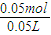 =1mol/L.
=1mol/L.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届度辽宁大连瓦房店中学高一上学期期末考试化学试卷 题型:选择题
将50mL某未知浓度的AlCl3溶液分别加到60mL1mol/LNaOH溶液或是60mL3mol/LNaOH溶液中,均能得到1.56gAl(OH)3沉淀,则AlCl3溶液的浓度可能是
A.0.4mol/L B. 0.5mol/L C.0.6mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省葫芦岛一高高一(上)月考化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com