
| 实验次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5. 01 |
| 2 | 6.00 | 10.99 |
| 3 | 12.00 | 17.60 |
| A.锥形瓶水洗后未烘干 | B.滴定过程中滴定管有漏水现象 |
| C.滴定过程中有少量溶液从锥形瓶中溅出 | D.滴定前滴定管内有气泡,滴定后没有了 |
 教材全解字词句篇系列答案
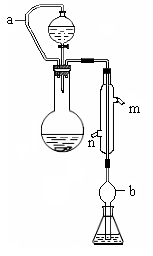
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:实验题








查看答案和解析>>
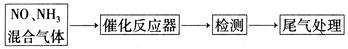
科目:高中化学 来源:不详 题型:实验题
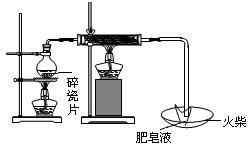
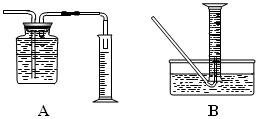
| | 现象 | 结论与解释 |
| 可能① | | |
| 可能② | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4和NO2的混合气体达到平衡时c(NO2)="0.0300" mol·L-1。
N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4和NO2的混合气体达到平衡时c(NO2)="0.0300" mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 烧杯编号 | ① | ② | ③ |
| 加入试剂 | 铁粉0.1g | 铁粉0.1g,0.1mol/LH2SO43mL | 0.1mol/LH2SO43mL |
| 红色出现时间(天) | 1天 | 4天左右 | 8天以上 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
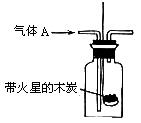

| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 | 充满红棕色气体,木条不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 | 充满红棕色气体,木条复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 | 充满红棕色气体,木条复燃 | NO2支持燃烧 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用天平称取4.0gNaOH固体,用100mL量筒配制1.00mol/L的NaOH溶液 |
| B.用25mL的滴定管(内装有标准NaOH溶液)滴定未知浓度的盐酸用去NaOH溶液22.32mL |
| C.用pH试纸测得新制氯水的pH为4 |
| D.常温下,用气球收集500mLNO2气体,求得NO2气体的物质的量为(0.5/22.4)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 思。经过用另一溶液简单处理后,表弟看到了一封有颜色的信,并很快写了回信。小张和表弟所用的溶液分别可能是( )。
思。经过用另一溶液简单处理后,表弟看到了一封有颜色的信,并很快写了回信。小张和表弟所用的溶液分别可能是( )。 A.前者是紫色石蕊试液,后者是稀盐酸 | B.前者是NaOH稀溶液,后者是稀硫酸 |
| C.前者是浓硫酸,后者是紫色石蕊试液 | |
| D.前者是米汤,后者是碘酒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com