
在同温同压条件下,已知: C+CO2 2CO(正反应是吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应是吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应是放热),正反应的反应速率为v2。对于上述反应,当温度同时升高时,v1 和v2的变化情况正确的是
2NH3(正反应是放热),正反应的反应速率为v2。对于上述反应,当温度同时升高时,v1 和v2的变化情况正确的是
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
科目:高中化学 来源: 题型:阅读理解
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |
查看答案和解析>>
科目:高中化学 来源: 题型:






| 一定条件 |
 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O

 或
或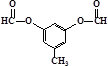
 或
或
 与G互为同分异构体
与G互为同分异构体查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.2Q2=Q1=92.4 B.Q2<Q1<92.4
C.Q1<Q2<92.4 D.Q1=Q2<92.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com