
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 钠加入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜片放入浓HNO3溶液中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
分析 A.氯气与水反应生成盐酸和次氯酸,次氯酸为弱电解质,保留化学式;
B.电荷不守恒;
C.原子个数不守恒;
D.二者反应生成硝酸铜和二氧化氮和水.
解答 解:A.Cl2通入水中,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.用FeCl3溶液腐蚀印刷电路板,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.钠加入水中,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.铜片放入浓HNO3溶液中,离子方程式:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2×10-7mol/Lmol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11mol/Lmol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
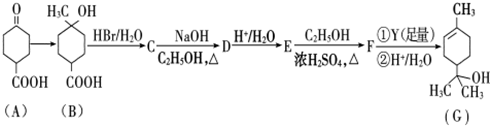
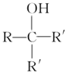
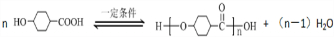 .
.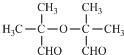 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
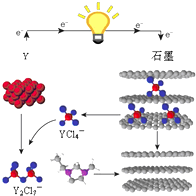 X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.
X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去固体Na2CO3中的少量NaHCO3 | 将混合物加热充分反应 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中通入SO2气体至紫色消失 |
| 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
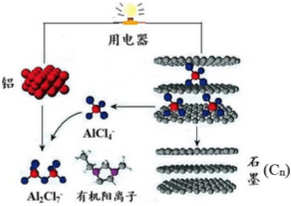 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7- | |
| D. | 充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸有氧化性,稀硫酸无氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝是应用最广泛的两种金属.完成下列填空:
铁、铝是应用最广泛的两种金属.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com