
下列化学用语不正确的是
A.二氧化碳的电子式是: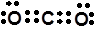 |
B.铝离子的结构示意图是:  |
C. 的中子数与质子数之差是2 的中子数与质子数之差是2 |
| D.Na2O2中的阳离子数与阴离子数之比为1:1 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.标准状况下,11.2 L氟化氢所含的分子数为0.5NA |
| C.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.5NA |
| D.常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为7.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有4.8g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28g,反应后全部气体用0.6mol/L Ba(OH)2溶液100mL吸收。下列有关叙述中正确的是
| A.原混合物中CuO与Fe2O3物质的量的比为l:l |
| B.原混合物中CuO与Fe2O3的质量比为2:1 |
| C.吸收CO2后的溶液中一定有Ba(HCO3)2 |
| D.吸收CO2后的溶液中生成白色沉淀的质量为11.82 g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在下列条件下,两种气体的分子数一定相等的是
| A.同温度,同体积的N2和O2 | B.同质量,不同密度的N2和CO |
| C.同压强,同体积的H2和CH4? | D.同体积,同密度的CO2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。
根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4 [ 已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s) g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(4)有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+ · Fe3+[ Fe3+(1-x) · Cr3+x · O4]。向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况)。计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量。
②所得气体中NO、NO2的体积比。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、 |
C. 、 、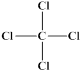 | D. 、1s22s22p63s23p6 、1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学科学需要借助化学专用语言来描述。下列有关化学用语表示正确的是
A.丙烷的球棍模型: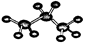 |
B.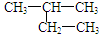 的名称:2-乙基丙烷 的名称:2-乙基丙烷 |
| C.乙酸的分子式:CH3COOH |
| D.氧化钠的化学式:Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若NA表示阿伏加德罗常数,下列说法正确的是
| A.Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间 |
| B.常温常压下,92 g NO2和N2O4的混合气体中含有的分子数目为2NA |
| C.一定条件下,密闭容器充入1molN2和3molH2充分反应,转移电子的数目为6NA |
| D.FeCl3溶液中,若Fe3+数目为NA,则Cl—数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
| A.2∶3 | B.1∶6 | C.3∶2 | D.1∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com