
下列说法不正确的是
| A. | B. | C. | D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl- -2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
|
|
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
硫酸铵在强热条件下分解:4(NH4)2SO4 = 6 NH3↑+ N2↑+3SO2↑+SO3↑+7H2O若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30 mL,加入同一种镁铝合金粉末,产生气体,有关数据列表如下(气体体积在标准状况下测定):
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸________(填“过量”“适量”或“不足量”),理由是________________。
(2)要计算盐酸的物质的量浓度,题中可作计算依据的数据是________。
(3)要计算合金中Mg、Al的物质的量之比,题中可作计算依据的数据是________,Mg、Al的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表示为:
2KClO3+4HCl (浓)==2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥法表示)。
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.1 mol Cl2,则转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
在A2+3B2 = 2C的反应中,经过t秒钟后,C的浓度增加了0.6mol/L,在此期间,反应速率V(B2)=0.45mol/(L·S),则t值为
A. 1秒 B. 1.5秒 C. 2秒 D. 2.5秒
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe2O3的混合物中加入120mL4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.21 mol C.0.16 mol D.0.14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
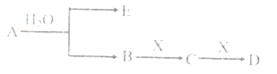
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。

请回答:a点溶液中所含溶质的化学式为__________ ,a-b之间的反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)=== C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g) △H2。则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.所有的不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞出的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com