

 .
.  ;
;分析 A的相对分子质最为68,则A的分子式为C5H8,1molA可以和2mol氢气完全加成,链烃A有支链且只有-个官能团,则A的结构简式为(CH3)2CHC≡CH,A与等物质的量的H2反应生成E,则E为(CH3)2CHCH=CH2,E与溴发生加成反应生成F,则F为结构简式为: ,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为
,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为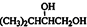 ,G和与HOOCCOOH发生酯化反应生成H为六元酯,则H为:
,G和与HOOCCOOH发生酯化反应生成H为六元酯,则H为: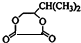 ,据此解答.
,据此解答.
解答 解:A的相对分子质最为68,则A的分子式为C5H8,1molA可以和2mol氢气完全加成,链烃A有支链且只有-个官能团,则A的结构简式为(CH3)2CHC≡CH,A与等物质的量的H2反应生成E,则E为(CH3)2CHCH=CH2,E与溴发生加成反应生成F,则F为结构简式为: ,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为
,F和氢氧化钠的水溶液发生取代反应生成G,G的结构简式为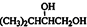 ,G和与HOOCCOOH发生酯化反应生成H为六元酯,则H为:
,G和与HOOCCOOH发生酯化反应生成H为六元酯,则H为: ,
,
(1)由上述分析可知,A的结构简式为(CH3)2CHC≡CH,名称为3-甲基-1-丁炔,
故答案为:(CH3)2CHC≡CH;3-甲基-1-丁炔;
(2)E为(CH3)2CHCH=CH2,与溴发生加成反应生成F,反应方程式为:(CH3)2CHCH=CH2+Br2→ ,
,
故答案为:(CH3)2CHCH=CH2+Br2→ ;
;
(3)G转化为H的化学方程式是: ,
,
故答案为: ;
;
(4)反应①是(CH3)2CHC≡CH与氢气发生加成反应生成(CH3)2CHCH=CH2,反应③是 在碱性条件下水解生成
在碱性条件下水解生成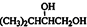 ,是取代反应,
,是取代反应,
故答案为:加成反应;取代反应;
(5)E为(CH3)2CHCH=CH2,与E具有相同官能团的E的同分异构体共有CH3CH2CH2CH=CH2、CH3CH2CH=CHCH3、(CH3)2C=CHCH3、(CH3)2C=CHCH3、CH2=C(CH3)CH2CH3,共4种,
故答案为:4;CH3CH2CH2CH=CH2、CH3CH2CH=CHCH3、(CH3)2C=CHCH3、(CH3)2C=CHCH3、CH2=C(CH3)CH2CH3.
点评 本题考查有机物的推断、有机反应类型、同分异构体、有机反应方程式书写等,确定A的分子式与结构是关键,再根据官能团的性质结合反应条件进行推断,题目难度中等,注意掌握官能团的性质与转化.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
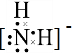 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
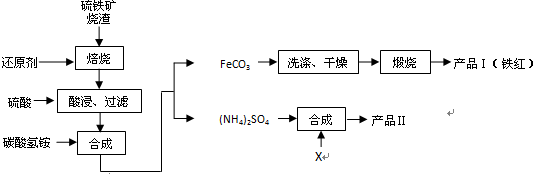
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com