
|
2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录.该化合晶体结构中的晶胞如图所示.镁原子间形成正六棱柱,六个硼原子位于棱柱内.则该化合物的化学式可表示为
| |
| [ ] | |
A. |
Mg14B6 |
B. |
Mg2B |
C. |
MgB2 |
D. |
Mg3B2 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:阅读理解
| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式 。
⑵钾、钙、镓的第一电离能从大到小的顺序是 。
⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。
⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。
⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2011届陕西省师大附中、西工大附中高三第五次适应性训练(理综)化学部分 题型:填空题
(15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式 。
⑵钾、钙、镓的第一电离能从大到小的顺序是 。
⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。
⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。
⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。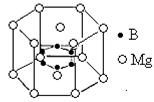
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年陕西省、西工大附中高三第五次适应性训练(理综)化学部分 题型:填空题
(15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式 。
⑵钾、钙、镓的第一电离能从大到小的顺序是 。
⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。
⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。
⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。
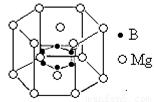
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省泰州市高三第一次模拟考试化学卷 题型:实验题
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题:

工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因 ;不用电解AlCl3的方法生产铝的原因 。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。

(3)写出Cu+的核外电子排布式 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是 。

A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。

步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com