
| 选项 | 目的 | 操作 |
| A | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 除去硫酸钡固体中的碳酸钡 | 向盛有足量盐酸的烧杯中加入该固体,用玻璃棒不断搅拌并充分浸泡,静置,过滤,洗涤,烘干 |
| D | 配制100mL1.0mol/LCuSO4溶液 | 将25gCuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na2CO3与CaCl2反应生成白色沉淀,而NaCl不能;
B.KNO3、NaCl的溶解度受温度影响不同;
C.碳酸钡溶于盐酸,而硫酸钡不溶于盐酸;
D.溶于100mL蒸馏水,导致溶液的体积大于100mL.
解答 解:A.Na2CO3与CaCl2反应生成白色沉淀,而NaCl不能,则滴加CaCl2溶液,观察是否出现白色浑浊可确定,故A正确;
B.KNO3、NaCl的溶解度受温度影响不同,则将混合物制成热的饱和溶液,冷却结晶,过滤可除杂,故B正确;
C.碳酸钡溶于盐酸,而硫酸钡不溶于盐酸,则向盛有足量盐酸的烧杯中加入该固体,用玻璃棒不断搅拌并充分浸泡,静置,过滤,洗涤,烘干可除杂,故C正确;
D.溶于100mL蒸馏水,导致溶液的体积大于100mL,应将25gCuSO4•5H2O溶于蒸馏水中配制100mL溶液,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、溶液配制等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N.
;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N. ,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不可能是氧化还原反应 | B. | 只能是复分解反应 | ||
| C. | 可能是置换反应 | D. | 不可能是化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
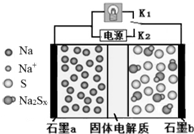 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( )| A. | 放电时,石墨电极a为正极 | |
| B. | 放电时,Na+从石墨b向石墨a方向迁移 | |
| C. | 可将装置中的固体电解质改成NaCl溶液 | |
| D. | 充电时,b极反应为Na2Sx-2e-=xS+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | 少量的NaOH溶液滴入NH4HCO3溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3- | |
| D. | 大理石溶于醋酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(HCO3-)+c(OH-) | B. | c(HCO3-)+c(CO32-)=0.1mol/L | ||
| C. | c(H2CO3)>c(CO32-) | D. | c(Na+)=c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com