
250 mL pH=12的某一元强碱(MOH)溶液与250 mL 0.025 mol·L-1的硫酸溶液相混合,假设混合后液体体积为500 mL.
试求:(1)混合液的pH;
(2)若原250 mL一元强碱中含溶质0.1 g,则M的相对原子质量为多少?
(3)若给混合液中分别滴入几滴甲基橙、无色酚酞、紫色石蕊试液,则溶液的颜色分别是什么?
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:广东省中山一中2012届高三上学期第三次统测化学试题 题型:058
2011年8月12日,网上传云南曲靖市越州镇有总量5000余吨的重毒化工废料铬渣由于非法丢放,毒水被直接排放南盘江中.
Ⅰ:某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
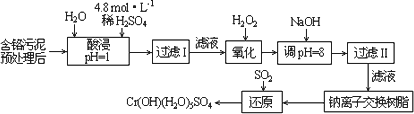
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
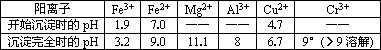
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需________.
(2)酸浸时,为了提高浸取率可采取的措施是________(至少答一点).
(3)加入H2O2的作用是________.
调节溶液的pH=8是为了除去________离子.
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是________.
(5)还原过程发生以下反应(请配平):
________Na2Cr2O7+________SO2+________=________Cr(OH)(H2O)5SO4+________Na2SO4;
Ⅱ:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀.阳极的电极反应式为________.在阴极附近溶液pH升高的原因是(用电极反应方程式解释)________.查看答案和解析>>
科目:高中化学 来源:山东省莱芜一中2011届高三上学期期末复习诊断性测试(二)化学试题 题型:013
|
设阿伏加德罗常数的数值为NA,下列说法正确的是 | |
| [ ] | |
A. |
250 mL 2 mol·L-1的氨水中含有NH3·H2O的分子数为0.5NA |
B. |
0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2NA |
C. |
22.4 L SO2气体,所含氧原子数为2NA |
D. |
t℃时,pH=6的纯水中含有OH-的个数为10-6NA |
查看答案和解析>>
科目:高中化学 来源:上海市虹口区2013年高考一模化学试题 题型:038
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用.完成下列计算∶
1.将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁.
(1)钢样中含铁________g.
(2)生成的CO2在标准状况下体积为________mL.
2.向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤.洗涤沉淀,将洗涤液与滤液合并后稀释至250 mL.取25 mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50 mL.计算原溶液中Fe3+的物质的量浓度.
3.铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)].将一块带锈铁片放入700 mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020 g铁.求∶
(1)反应后溶液中溶质的成分与物质的量.
(2)原带锈铁片中铁锈的质量分数.
4.用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示).经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11∶12.已知两种阳离子为Fe2+与Fe3+,物质的量之比为2∶1.请通过计算确定X的化学式.
查看答案和解析>>
科目:高中化学 来源:上海市嘉定区2013年高考一模化学试题 题型:058
某同学进行试验探究时,欲配制1.0 molL-1 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.
为探究原因,该同学查得Ba(OH)2·8H2O部分溶解度数据,见下表:
1.烧杯中未溶物仅为BaCO3,理由是________.
2.假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题纸上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管

3.将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量.
实验如下:①配制250 mL 约0.1 mol·L-1Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,搅拌,将溶液转入________,洗涤,定容,摇匀.②滴定:准确量取25.00 ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将________(填“0.020”、“0.05”、“0.1980”或“1.5”)molL-1盐酸装入50 ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
4.室温下,________(填“能”或“不能”) 配制1.0 mol·L-1Ba(OH)2溶液,说明理由________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com