
分析 根据n=cV、m=nM计算出配制100mL0.5mol/L NaOH溶液需要氢氧化钠的质量;根据稀释过程中溶质的物质的量不变计算出稀释后氢氧化钠溶液的浓度.
解答 解:100mL0.5mol/L NaOH溶液中含有氢氧化钠的物质的量为:0.5mol/L×0.1L=0.05mol,配制该溶液需要氢氧化钠的质量为:40g/mol×0.05mol=2.0g;
加水稀释到500mL后,稀释过程中氢氧化钠的物质的量不变,该溶液的物质的量浓度为:$\frac{0.05mol}{0.5L}$=0.1mol/L,
答:配制100mL0.5mol/L NaOH溶液需要2.0g氢氧化钠,稀释后氢氧化钠溶液的浓度为0.1mol/L.
点评 本题考查了物质的量浓度的计算、溶液的配制,题目难度不大,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
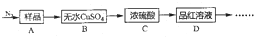
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g CH4所含共价键数目为2NA | |
| B. | 0.5NA 个氯气分子与水反应转移电子数为0.5NA | |
| C. | 50mL12mol/L盐酸与足量的MnO2共热,转移的电子数为0.3NA | |
| D. | 1 L0.2mol/L的Na2S溶液中离子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | 下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从碘水中萃取碘 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,收集完馏分后,先停止加热,待恢复室温后再停止通冷凝水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
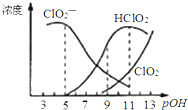 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | pH=1的溶液:NH4+、Al3+、SO42-、Br- | |
| C. | 0.1 mol•L-1FeCl3溶液:NH4+、H+、I-、SCN- | |
| D. | 常温下,在c(H+)水•c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com