
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为__________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-) D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________。
【答案】(1)b>a>c;(2)NaCN+CO2+H2O=NaHCO3+HCN;
(3)B、D;(4)Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
【解析】
试题分析:(1)根据盐类水解的规律,越弱越水解,电离出H+能力:CH3COOH>H2CO3>HCN>HCO3-,因此pH由大到小:CO32->CN->CH3COO-,即b>a>c;(2)电离平衡常数:H2CO3>HCN>HCO3-,因此反应是NaCN+CO2+H2O=NaHCO3+HCN;(3)反应后的溶质为HCN、NaCN,测的c(Na+)>c(CN-),说明CN-的水解程度大于HCN的电离程度,水溶液显碱性,CN-+H2O![]() HCN+OH-,即c(OH-)>c(H+),根据质子守恒,得出:2c(OH-)+c(CN-)=c(HCN)+2c(H+),根据物料守恒,c(HCN)+c9CN-)=0.01mol·L-1,故选项B、D正确;(4)Al3+和HCO3-发生双水解,Al3++3HCO3-=Al(OH)3↓+3CO2↑;(5)NaHC2O4说明HC2O4-的电离程度大于其水解程度,且程度是微弱的,因此离子浓度是:c(Na+)>c(HC2O4-)>c(H+)> c(C2O42-)> c(OH-)。
HCN+OH-,即c(OH-)>c(H+),根据质子守恒,得出:2c(OH-)+c(CN-)=c(HCN)+2c(H+),根据物料守恒,c(HCN)+c9CN-)=0.01mol·L-1,故选项B、D正确;(4)Al3+和HCO3-发生双水解,Al3++3HCO3-=Al(OH)3↓+3CO2↑;(5)NaHC2O4说明HC2O4-的电离程度大于其水解程度,且程度是微弱的,因此离子浓度是:c(Na+)>c(HC2O4-)>c(H+)> c(C2O42-)> c(OH-)。


科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
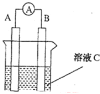
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法,错误的是( )
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表中共有18列,16个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I和陈述II均正确且有因果关系的是
选项 | 陈述I | 陈述II |
A | 常温下铁不溶于浓硝酸,铜溶于浓硝酸 | 铜的金属性强于铁 |
B | SiO2与氢氧化钠、氢氟酸均反应 | SiO2是酸性氧化物 |
C | 氨气液化时吸热 | 氨气常用作制冷剂 |
D | 氧化镁很坚固、熔点高 | 氧化镁用来制造耐火坩埚等实验仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色澄清的溶液中,可能大量共存的离子组是( )
A. Cl-、SO32-、Fe2+、H+ B. NH4+、Al3+、NO3-、HCO3-
C. Na+、K+、OH-、AlO2- D. K+、Na+、SO42-、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法曾广泛用于工业制纯碱(Na2CO3),是我国科学家为人类做出的重大贡献.现有25℃时,浓度为0.10mol/LNa2CO3溶液.请回答:
(1)该溶液中c(H+) c(OH﹣) (填“>”、“=”或“<”).
(2)用离子方程式解释(1)的原因: .
(3)下列说法正确的是(填字母) .
a.Na2CO3在水中完全电离
b.c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=0.1mol/L
c.c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+)
(4)用石墨作电极电解Na2CO3水溶液时,阴极反应式是 .
(5)Na2CO3溶液中的电荷守恒关系式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1 KCl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1 HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com