
【题目】下列物质中,既含离子键又含共价键的是 ( )
A. Na2O B. NaOH C. NH3 D. CaBr2
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是()
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 氢氧化钠溶液与盐酸反应:OH-+H+=H2O
C. 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu
D. 氯化钡溶液与稀硫酸反应:SO42-+Ba2+= BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂.某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(夹持装置和A中加热装置已略,气密性已检验) 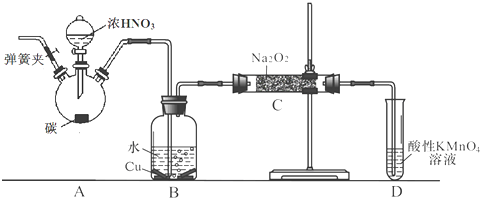
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2﹣可将MnO4﹣还原为Mn2+且无气体生成.
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠.
(1)A中反应的化学方程式是 .
(2)B中观察的主要现象是 , D装置的作用是 .
(3)经检验C产物中亚硝酸钠含量较少. a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠.
生成碳酸钠的化学方程式是 . 为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是(写名称).
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。

①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。

依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):

已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述不正确的是( )
A.常温常压下,7.8 gNa2O2含有的Na+数为0.2NA
B.标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA
C.标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L
D.50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图①可表示将SO2气体通入溴水时pH的变化
B. 图②表示KNO3的溶解度曲线,a点是80 ’C的KNO3的不饱和溶液
C. 图③表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 图④表示室温下,0.100 mol/L NaOH溶液分別滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证SO2的性质,某同学利用输液管设计了如图1微型实验: 
回答下列问题:
(1)仪器A的名称是 .
(2)装置l中的现象是;装置3中证明SO2具有性.
(3)下列说法正确的是 .
A.装置2中紫色石蕊试液变红的原因是SO2+H2O=H2SO3 , H2SO3显酸性
B.实验结束后将输液管1加热溶液不变色
C.实验结束后,可由a导管向装置中加水,将气体赶出后再拆装置,防止残留的SO2有毒气体污染环境
D.在a导管处用向下排空气法收集SO2
(4)装置4中酸性高锰酸钾褪色,经测定反应后溶液中含有Mn2+和SO42﹣ , 请写出该反应的离子方程式 .
(5)该学生还利用上图部分仪器组装成的装置(如图2)证明S、C、Si非金属性强弱.可共选择的试剂有:硫酸、亚硫酸、硝酸、木炭、硅酸钠溶液. 
①装置A中试剂X是;装置1中反应的化学方程式是 .
②实验结论:因为酸性强弱是>>(填化学式),故非金属性是S>C>Si.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com