
| 实验操作 | 实验目的 | |
| A | 向苯和苯酚混合溶液中滴加过量浓溴水 | 除去混合溶液中的苯酚 |
| B | 向待测液中加入饱和碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3mL5%CuSO4溶液中滴加3-4滴1%氢氧化钠溶液,再向其中加入0.5mL乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯酚与浓溴水反应制备三溴苯酚,三溴苯酚易溶于苯;
B.乙酸与碳酸钠反应生成气体、乙醇与碳酸钠不分层、乙酸乙酯与碳酸钠分层;
C.滴加3-4滴2%氢氧化钠溶液,NaOH不足;
D.溴乙烷与氢氧化钠溶液共热,发生水解反应生成NaBr,检验溴离子应在酸性溶液中.
解答 解:A.苯酚与浓溴水反应制备三溴苯酚,三溴苯酚易溶于苯和苯酚,不易分离,故A错误;
B.乙酸与碳酸钠反应生成气体、乙醇与碳酸钠不分层、乙酸乙酯与碳酸钠分层,现象不同,可鉴别,故B正确;
C.滴加3-4滴2%氢氧化钠溶液,NaOH不足,检验-CHO应在碱性溶液中,故C错误;
D.溴乙烷与氢氧化钠溶液共热,发生水解反应生成NaBr,检验溴离子应在酸性溶液中,应先加酸至酸性,再滴加硝酸银溶液检验,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的分离提纯、有机物的结构与性质、离子检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:C2H4 | |
| B. | HCl的电子式: | |
| C. | CH3COOH官能团名称:羟基 | |
| D. | 氨水的电离方程式:NH3•H2O?NH${\;}_{4}^{+}$+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
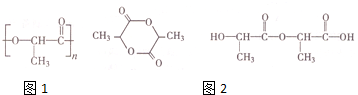
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和甲苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 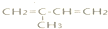 与等物质的量的溴反应产物仅有2种 与等物质的量的溴反应产物仅有2种 | |
| C. | 分子式为C8H10且属于芳香烃的同分异构体有3种 | |
| D. | 等质量的乙烷、乙烯完全燃烧消耗氧气的量前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | 不能确定Na+和Cl-是否存在,CO${\;}_{3}^{2-}$一定不存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)≥0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2有漂白性,工业上常用它来漂白纸浆 | |
| B. | 单质硅具有半导体性能,可以制成光电池 | |
| C. | Fe2O3是一种红棕色粉末,常用作红色油漆 | |
| D. | 明矾在天然水中生成Al(OH)3胶体,可用作自来水的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢和钢化玻璃成分不同,但都属于复合材料 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、Cl2都可用浓硫酸干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
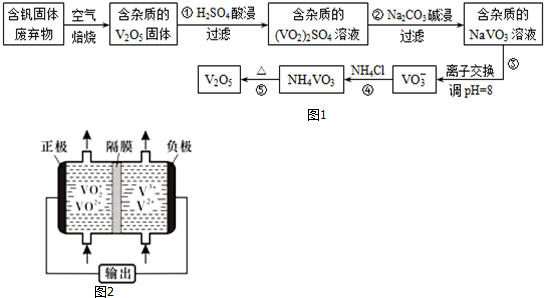
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com