
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
科目:高中化学 来源: 题型:解答题
 最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图:
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图: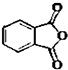 +C4H9OH$\stackrel{H_{2}SO_{4}}{→}$
+C4H9OH$\stackrel{H_{2}SO_{4}}{→}$ 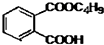 $→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$
$→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$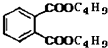
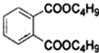 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )
白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )| A. | 10 | B. | 24 | C. | 12 | D. | 28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | NaOH、H2SO4、Ba(OH)2 | D. | NaBr、H2SO4、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com