
| a | |||||||
| b | c | d | |||||
| e | f | g | h |
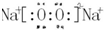 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).分析 由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为Na、f为Al、g为S、h为Cl.
(1)h为Cl原子核外电子排布为1s22s22p63s23p5,只有s、p轨道电子云;核外子没有运动状态相同的电子;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;
同周期自左而右元素非金属性增强,可以利用最高价含氧酸中强酸制备弱酸进行验证;
(3)d、e元素形成的四原子化合物为Na2O2;b、g元素形成的分子SC2为直线型对称结构;
(4)NH4Al(SO4)2溶液中铵根离子与铝离子相互抑制水解,而NH4HSO4溶液中氢离子抑制铵根离子水解,铝离子抑制程度不如酸的抑制程度大;
(5)NH4HSO4与 NaOH按物质的量1:1反应时为硫酸钠、硫酸铵混合溶液,溶液呈酸性,二者混合呈中性,还有一水合氨生成,为硫酸钠、硫酸铵、一水合氨混合溶液;
(6)根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-),开始发生反应:Al3++3OH-=Al(OH)3↓,在发生反应:NH4++OH-=NH3•H2O,最后发生反应:Al(OH)3+OH-=AlO2-+2H2O,根据离子方程式计算判断加入32mLNOH溶液后,继续滴加至35mL时反应离子方程式;
计算n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
解答 解:由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为Na、f为Al、g为S、h为Cl.
(1)h为Cl原子核外电子排布为1s22s22p63s23p5,只有s、p轨道电子云,有4种伸展方向不同的电子,核外子没有运动状态相同的电子,最外层有7种运动状态不同的电子,
故答案为:4;7;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+,
同周期自左而右元素非金属性增强,故非金属性N>C,可以利用最高价含氧酸中强酸制备弱酸进行验证,反应方程式为:2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O,
故答案为:O2->Na+;N;2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O;
(3)d、e元素形成的四原子化合物为Na2O2,电子式为: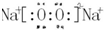 ,b、g元素形成的分子SC2为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,
,b、g元素形成的分子SC2为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,
故答案为: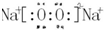 ;非极性;
;非极性;
(4)NH4Al(SO4)2,溶液中铵根离子与铝离子相互抑制水解,而NH4HSO4溶液中氢离子抑制铵根离子水解,铝离子抑制程度不如酸的抑制程度大,则NH4HSO4溶液中铵根离子浓度更大,
故答案为:小于;
(5)NH4HSO4与 NaOH按物质的量1:1反应时为硫酸钠、硫酸铵混合溶液,溶液呈酸性,二者混合呈中性,还有一水合氨生成,为硫酸钠、硫酸铵、一水合氨混合溶液,则反应后各离子浓度由大到小的排列顺序是:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(6)10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,
32mL 1mol/L NaOH溶液中NaOH物质的量为0.032L×1mol/L=0.032mol,由Al3++3OH-=Al(OH)3↓,可知完全沉淀铝离子消耗0.03mol NaOH,消耗NaOH溶液30mL,由NH4++OH-=NH3•H2O,可知铵根离子完全反应消耗NaOH为0.01mol,又消耗NaOH溶液10mL,故加入32mLNOH溶液后,继续滴加至35mL时反应离子方程式为:NH4++OH-=NH3•H2O;
20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:NH4++OH-=NH3•H2O;0.022.
点评 本题考查结构位置性质关系,是对学生综合能力的考查,需要学生具备扎实的基础,难度较大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 含大量MnO4-的溶液中:Na+、K+、Cu2+、Fe3+ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 酸性溶液中:Ba2+、NO3-、K+、AlO2- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、I-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
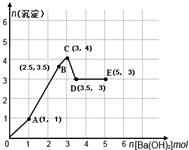 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A. | O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | A→B:2Al3++3SO42-+3Ba2++6OH2-=3BaSO4↓+2Al(OH)3↓ | |
| C. | B→C:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O | |
| D. | D→E:NH4++OH-=NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5s | B. | 大于5s | C. | 小于5s | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.8mol/L | D. | 1.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Ba(OH)2溶液可鉴别(NH4)2SO4、NH4Cl、Na2SO4、NaCl四种溶液 | |
| B. | 用溴水和KSCN溶液判断FeBr3溶液中混有FeBr2 | |
| C. | 用Ba(NO3)2溶液和硝酸检验亚硫酸钠固体是否变质 | |
| D. | 用NaOH溶液提纯混有MgCl2杂质的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
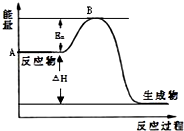 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com