
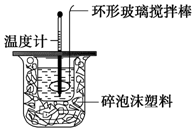
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2S O4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
分析 Ⅰ.(1)依据使用溶液的体积,选择合适的容量瓶,依据M=CVM计算溶质的质量;
(2)氢氧化钠为腐蚀品要小烧杯中称量,结合托盘天平的使用方法选择称量固体氢氧化钠所用的仪器;
Ⅱ.(1)硫酸与氢氧化钠反应生成硫酸钠和水,结合中和热为57.3kJ•mol-1,书写热化学方程式;
(2))①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.实验装置保温、隔热效果差,导致部分热量损失;
b.量取氢氧化钠溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,导致部分热量散失;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,导致盐酸的起始温度偏高;
解答 解:Ⅰ.(1)要使用245mL NaOH溶液,应选择250mL容量瓶,实际配制250mL0.50mol/L NaOH溶液溶液,需要氢氧化钠的质量m=0.25L×0.5mol/L×40g/mol=5.0g;
故答案为:5.0g;
(2)氢氧化钠要在称量瓶或者小烧杯中称量,称量固体氢氧化钠所用的仪器有天平、小烧杯和药匙,
故答案为:abe;
Ⅱ.(1)中和热为57.3kJ•mol-1,即生成1mol水放出57.3KJ热量,则1mol硫酸与2mol氢氧化钠反应生成硫酸钠和2mol水,放出热量为114.6KJ,所以其热化学方程式:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1;
(2)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2组舍去,温度差平均值=$\frac{4.0℃+3.9℃+4.1℃}{3}$=4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-$\frac{1.3376kJ}{0.025mol}$=-53.5kJ/mol,
故答案为:-53.5kJ/mol;
③a.实验装置保温、隔热效果差,导致部分热量损失,测定中和热偏小,故a选;
b.量取氢氧化钠溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,故b选;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,导致部分热量散失,导致中和热偏小,故c选;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,导致盐酸的起始温度偏高,导致中和热偏小,故d选;
故选:abcd.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法以及测定反应热的误差等问题.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
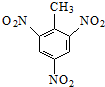 的系统命名:2,4,6-三硝基甲苯;
的系统命名:2,4,6-三硝基甲苯;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
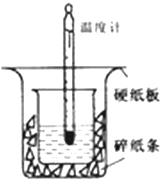 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 28.6% | C. | 15% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、SO42-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Cu2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中最多有12个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有4种 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com