
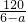 ,则XeO3的系数为______(用a表示).
,则XeO3的系数为______(用a表示).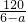 -36=
-36= ,故答案为:
,故答案为: ;
;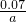 mol,故答案为:
mol,故答案为: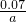 ;
;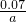 molXeFa与水反应生成0.005molXeO3,XeFa与XeO3的物质的量之比等于化学计量数之比,则:
molXeFa与水反应生成0.005molXeO3,XeFa与XeO3的物质的量之比等于化学计量数之比,则: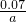 mol:0.005mol=
mol:0.005mol=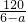 :
: ,解得a=3.5,故答案为:3.5;
,解得a=3.5,故答案为:3.5;

科目:高中化学 来源: 题型:
| 120 |
| 6-a |
| 36a-96 |
| 6-a |
| 36a-96 |
| 6-a |
| 0.07 |
| a |
| 0.07 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:013
氙和氟按一定比例混合,在一定条件下直接反应:Xe+2F2=XeF4+218 KJ,这说明:①Xe的结构和稳定性是相对的;②Xe在一定条件下可显正化合价;③XeF4是相对稳定的化合物;④加压有利于XeF4的生成。以上结论正确的是( )
A.只有①②
B.只有①④
C.只有①②④
D.全部
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.只有①②
B.只有①④
C.只有①②④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com