
【题目】下列物质不属于合金的是
A. 铝 B. 青铜 C. 不锈钢 D. 生铁
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应①Fe(s)+C02(g) ![]() FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g) ![]() 2C02(g) △H2=b kJ·mol-
2C02(g) △H2=b kJ·mol-
反应③2Fe(s)+02(g) ![]() 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a ___________0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量变大
C. 升高温度,反应速率加快,反应放出的热量不变
D. 增加反应物的浓度,反应速率加快,原因是单位体积内增加了活化分子的数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于等电子体的说法中,正确的是
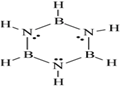
A. N2与CO不属于等电子体,故它们的熔沸点、溶解度相差较大
B. PO43-与SO42-不属于等电子体,故结构不相似
C. NO2-与O3属于等电子体,故NO2-为O2的同素异形体
D. 苯与硼氮苯(路易斯结构式如上图)属于等电子体,故硼氮苯中含有大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)![]() N2O4(g);△H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是
N2O4(g);△H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是
A. 相对平均分子质量增大 B. NO2的转化率提高
C. NO2的质量分数增大 D. 反应放出的总热量大于原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2 L的密闭容器中,A气体与B气体发生可逆反应生成C气体,
反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,
温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列
叙述正确的是
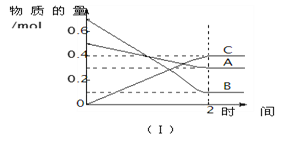
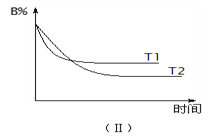
A. 2 min内A的化学反应速率为0.1 mol/(L·min)
B. 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C. 在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D. 在T℃时,若A的浓度减少了0.1 mol/L,则B的浓度会减少0.3 mol/L,C的浓度会增加0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应①Fe(s)+C02(g) ![]() FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g) ![]() 2C02(g) △H2=b kJ·mol-
2C02(g) △H2=b kJ·mol-
反应③2Fe(s)+02(g) ![]() 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a ___________0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为C5H10O,它能发生银镜反应,若将它与H2加成,所得产物的结构简式可能是
A.( CH3)3CCH2OH B.CH3CH2CH(OH)CH2CH3
C.CH3CH(OH)CH2CH2CH3 D.CH3CH2C(CH3)2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com