
| A. | $\frac{8b-3a}{2V}$mol•L-1 | B. | $\frac{8b-3a}{V}$mol•L-1 | C. | $\frac{a-2b}{V}$mol•L-1 | D. | $\frac{a-2b}{2V}$mol•L-1 |
分析 混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y;一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-,则:①2x+4y=amol;
另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=n(BaSO4)=n(BaCl2),再利用电荷守恒可知每份中2n(Mg2+)+3n(Al3+)=2(SO42-),即:②2x+3y=2bmol,据此计算每份中n(Mg2+),根据c=$\frac{n}{V}$计算镁离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y,
一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-,则:①2x+4y=amol,
另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=BaSO4=n(BaCl2)=bmol;
由电荷守恒可知每份中:2n(Mg2+)+3n(Al3+)=2(SO42-),即:②2x+3y=2bmol,
联立①②解得:x=$\frac{8b-3a}{2}$mol、y=(a-2b)mol,
每份溶液的体积为0.5VL,则每份混合溶液中Mg2+的浓度为:c(Mg2+)=$\frac{\frac{8b-3a}{2}mol}{0.5VL}$=$\frac{8b-3a}{V}$mol/L,
溶液具有均一性,则原混合液中镁离子的浓度为:$\frac{8b-3a}{V}$mol/L,
故选B.
点评 本题考查了混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电荷守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl-、Na+、SO42-、Al3+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑥ | C. | ③④⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaNO2是氧化剂 | |
| B. | NH4Cl中的氮元素被氧化 | |
| C. | 每生成1 mol N2转移的电子的物质的量为6 mol | |
| D. | N2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、K2CO3 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3和NaHCO3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
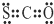
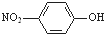
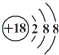

| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com