
三聚氰胺又名蛋白精[分子式:C3N3(NH2)3,相对分子质量:126]是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是 ( )。
A.2.52 g三聚氰胺含氮原子数目为0.12NA
B.标准状况下1 mol的三聚氰胺的体积为22.4 L
C.三聚氰胺含氮量约为10%
D.三聚氰胺的摩尔质量为126
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:选择题
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
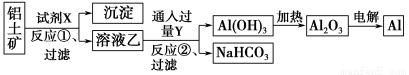
下列叙述正确的是 ( )。
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:填空题
汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:

(1)A、B、C三种物质可以归为一类的依据是 。
(2)将C归为化合物,将D归为单质的理由是 。
(3)用化学反应方程式表示为 。
化学变化过程中消耗的A物质和生成的C物质的质量比为 。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可) 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
下列叙述正确的是 ( )。
A.1 L 0.1 mol·L-1碳酸钠溶液的阴离子总数等于0.1NA
B.将1体积c mol·L-1硫酸用水稀释为5体积,得到0.2c mol·L-1硫酸
C.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol·L-1
D.将w g a%NaCl溶液蒸发掉 g水,得到4a% NaCl溶液
g水,得到4a% NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-1物质的量 气体摩尔体积练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )。
A.等质量的N2和CO所含分子数均为NA
B.在标准状况下,22.4 L CH4与18 g H2O所含的电子数均为10NA
C.一定温度下,1 L 1 mol·L-1的CH3COONa溶液含NA个CH3COO-
D.1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-2物质的分离和提纯练习卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能达到相应实验目的的是 ( )。
选项ABCD
实验
目的除去KCl中少量MnO2用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸用含有少量NH4Cl杂质的NaCl溶液制备氯化钠晶体 除去乙烯中少量SO2
实验仪器或装置 烧杯、玻璃棒、分液漏斗100 mL容量瓶、玻璃棒、烧杯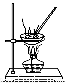
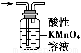
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-1化学实验仪器及操作练习卷(解析版) 题型:选择题
根据常见仪器的特点及使用注意事项回答下列问题。
(1)现有下图所示A、B、C、D四种仪器,写出名称:
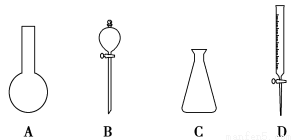
A. ,B. ,
C. ,D. 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有 (填序号)。
(3)以下是中学化学实验中常见的定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
①其中标有仪器使用温度的是 (填编号)。
②实验时用来精确量取液体体积的是 (填编号)。
③使用前要检查仪器是否漏液的是 (填编号)。
(4)玻璃棒的作用主要有以下四种:①搅拌、②引流、③蘸取溶液、④转移固体。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是 (填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以制得纯净的食盐”的实验中玻璃棒的作用可能是 (填写编号)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是 ( )。
A.应用盖斯定律,可计算某些难以直接测量的反应焓变
B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1
C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热
D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第8练金属及其化合物练习卷(解析版) 题型:填空题
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为____________________________________________________。
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。
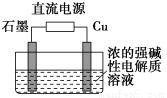
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O电解,Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com