
| 1 |
| 2 |
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变)。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二下学期期中考试化学试卷(解析版) 题型:填空题
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。
(1)完成下列关于甲烷(CH4)燃料电池的填空:
①甲烷与氧气反应的化学方程式为:
②已知燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-="=" CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
③随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
④通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
(2)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
①该电池反应的总离子方程式为____________________________
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料。
(1)写出肼与一氧化氮反应的化学方程式 。
(2)肼――空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,负极的电极反应式是 。
(3)下图是一个电化学装置示意图。用肼――空气燃料电池做此装置的电源。
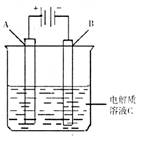
①如果A为含有铁、银、金、碳等杂质的粗铜,B为纯铜,C为CuSO4。通电一段时间后,溶液中Cu2+的浓度将 填“增大”、“减小”或“不变”)。
②如果A是铂电极,B是石墨电极,C是硫酸性,阴极的电极反应式是 。利用该装置可制得少量过氧化氢:在阳极上SO42―被氧化成S2O82―(过二氧酸根离子)S2O82―与H2O反应生成H2O2,S2O82―+2H2O=2S2O42―+H2O2+2H+。若要制取1molH2O2,该燃料电池理论上需消耗 molN2H4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com