
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的结构简式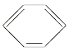 看,苯分子中含有碳碳双键,应属于烯烃
看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
科目:高中化学 来源: 题型:
【题目】利用如图装置可以进行实验并能达到实验目的的是( )

选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用KMnO4和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与浓硝酸制取并收集纯净干燥的NO2 | 水 | 浓硫酸 |
C | 用生石灰与浓氨水制取并收集纯净干燥的NH3 | 水 | 浓硫酸 |
D | 用铜片和浓硫酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中存在大量的Na+、Cl-、Cu2+、SO42-,欲除去其中的Cu2+、SO42-,设计工艺流程如图所示:

下列说法不正确的是
A.NaOH的作用是除去Cu2+B.试剂a 为Na2CO3,试剂b为BaCl2
C.流程图中,操作x为过滤D.试剂c为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
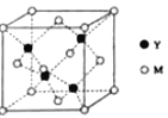
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是( )
A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+
B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.实验I、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的键线式如图所示,判断下列说法中不正确的是
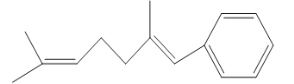
A.它可以使酸性KMnO4溶液褪色
B.1mol该有机物可以与2mol溴水发生加成反应
C.它可与Cl2发生取代反应
D.1mol该有机物燃烧消耗氧气为18mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的分子式或结构简式:
(1)1L烷烃C的蒸气完全燃烧时,生成同温同压下15L水蒸气:__________。
(2)分子式为CmH20的烷烃中m为________。
(3)碳、氢原子个数之比为2∶5的烷烃的分子式为__________,它的同分异构体的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脲醛树脂的合成与酚醛树脂类似,生成线型脲甲醛树脂的方程式为:n![]() +nHCHO
+nHCHO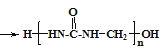 +xH2O,下列说法不正确的是( )
+xH2O,下列说法不正确的是( )
A.网状的脲甲醛树脂以如图所示结构单元为主
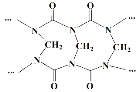
B.方程式中的化学计量数x=n-1
C.脲甲醛树脂合成过程中可能存在中间体![]()
D.通过质谱法测定线型脲甲醛树脂的平均相对分子质量,可得其聚合度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com