
| A | 用大理石盐酸反应制取CO2 气体,立即通入一定浓度Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3酸性比H2SiO3酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中一种几种 |
| C | 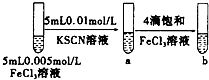 | 试管b比试管a中溶液红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 等体积PH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.盐酸易挥发,盐酸与硅酸钠反应;
B.先滴加硝酸酸化,再滴加BaCl2溶液,白色沉淀可能为硫酸钡或AgCl,且硝酸具有强氧化性,可氧化亚硫酸根离子;
C.增大铁离子浓度,有利于生成络离子;
D.pH=3的两种酸,HA放出的氢气多,则HA酸的浓度大,为弱酸.
解答 解:A.盐酸易挥发,盐酸与硅酸钠反应,则不能比较碳酸、硅酸的酸性强弱,故A错误;
B.先滴加硝酸酸化,再滴加BaCl2溶液,白色沉淀可能为硫酸钡或AgCl,且硝酸具有强氧化性,可氧化亚硫酸根离子,则原溶液中可能存在银离子,故B错误;
C.增大铁离子浓度,有利于生成络离子,试管b比试管a中溶液的红色深,平衡向正反应方向移动,故C正确;
D.pH=3的两种酸,HA放出的氢气多,则HA酸的浓度大,为弱酸,即HB的酸性比HA的强,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理等为解答的关键,涉及酸性比较、离子检验、平衡移动等,注意实验评价性分析,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径大小:Z>Y | |
| B. | Z和Y、W都能形成A2B2型的化合物 | |
| C. | Y和W形成的氢化物的稳定性:W>Y | |
| D. | X、Y、Z、W四种元素形成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卢瑟福首先提出了原子学说 | |
| B. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| C. | 利用同位素治疗肿瘤证明任何同位素对人都不会造成危害 | |
| D. | 利用焰色反应可以鉴别所有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
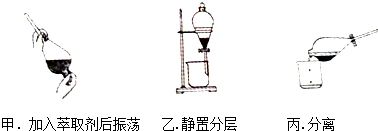 某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:
某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中通入少量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO32-+H2SiO3 | |
| B. | 饱和石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO3- | |
| C. | 向KI溶液中滴入稀硫酸,并且在空气中充分振荡:4H++4I-+O2═2I2+2H2O | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com