
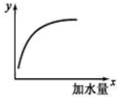
 如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )
如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )| A. | c(H+)或 c(OH-) | B. | HA的电离平衡常数Ka | ||
| C. | c(H+)/c(HA) | D. | n(H+)或 n(OH-) |
分析 根据图象可知,加入水稀释过程中,纵坐标y的数值逐渐增大,
A.弱酸溶液在稀释过程中溶液中氢离子浓度减小;
B.电离平衡常数与温度有关,温度不变,电离平衡常数不变;
C.稀释过程中HA分子的物质的量逐渐减小,氢离子的物质的量逐渐增大,则该比值增大;
D.稀释过程中HA的电离程度增大,则氢离子的物质的量增大;氢氧根离子的浓度逐渐增大,则氢氧根离子的物质的量也增大.
解答 解:根据图象可知,加入水稀释HA的过程中,纵坐标y会逐渐增大,
A.稀释HA溶液的过程中,溶液中的氢离子的物质的量浓度会逐渐减小,故A错误;
B.HA的电离平衡常数Ka只受温度影响,与加入水的量无关,故B错误;
C.稀释过程中HA分子的物质的量逐渐减小,氢离子的物质的量逐渐增大,在同一溶液中,则该比值会逐渐增大,与图象变化一致,故C正确;
D.稀释过程中HA的电离程度逐渐增大,则溶液中n(H+)逐渐增大;由于稀释过程中氢离子浓度减小,则氢氧根离子的浓度增大,所以稀释过程中氢氧根离子的物质的量逐渐增大,故D正确;
故选CD.
点评 本题考查了弱电解质的电离平衡,题目难度中等,注意掌握影响弱电解质电离的因素,明确水的离子积、弱电解质的电离平衡常数只受温度影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 硅与NaOH溶液的反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | 硫酸与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 氯气溶于水的反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100ml容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、 引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KW均为1×10-14 | B. | 若a=12则b=2 | ||
| C. | a、b为固定值 | D. | 水电离出的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径大小:D>B>A | |
| B. | B的单质既能和酸反应,又能和碱反应 | |
| C. | A分别与C、D形成的化合物均易溶于水 | |
| D. | 最高价氧化物对应水化物的酸性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
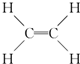 ,B中决定其性质的重要官能团的名称为羟基.
,B中决定其性质的重要官能团的名称为羟基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com