
| A. | 原子半径:Y>Z>X>W | |
| B. | 气态氢化物的热稳定性:Y<Z | |
| C. | 简单阴离子的还原性:Y>X | |
| D. | 最高价氧化物对应的水化物的酸性:Z>Y |
分析 W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子的半径大小为:Y>Z>W>X,故A错误;
B.Y为S、Z为Cl元素,非金属性Cl>S,则气态氢化物的稳定性:H2S<HCl,即Y<Z,故B错误;
C.非金属性O<S,则阴离子的还原性S2->O2-,故C正确;
D.非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则最高价含氧酸的酸性:Z>Y,故D正确;
故选A.
点评 本题考查原子结构和元素周期律的综合应用,为高频考点和常见题型,题目难度中等,侧重考查学生分析、推断能力,明确元素周期律内涵即可解答,注意掌握非金属性、金属性强弱判断方法.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
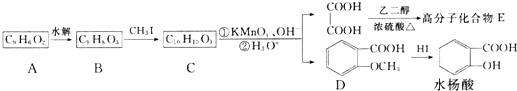
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 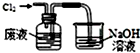 氧化废液中的溴化氢 | B. | 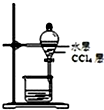 分离CCl4层和水层 | ||
| C. |  分离CCl4和液溴 | D. | 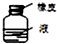 长期贮存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个Al(OH)3胶体粒子的质量为78g | |
| B. | 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 标准状况下,2.24 L己烷中共价键数目为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
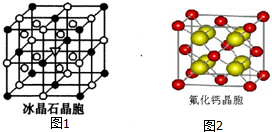 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
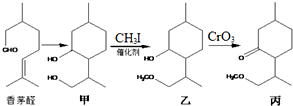
| A. | 香茅醛能发生加聚反应和缩聚反应 | |
| B. | “甲→乙”发生了取代反应 | |
| C. | 甲中不同化学环境的羟基化学性质不同 | |
| D. | 香茅醛存在顺反异构现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| A. | 实验①中,若5min时测得n(M)=0.050mol,则0~5min时间内,用N表示的平均反应速率v(N)=l.0×10-2 mo1•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 该反应的正反应方向为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
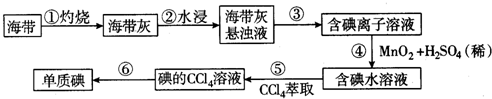
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
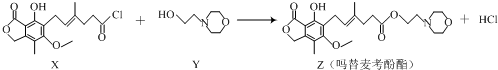
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com