
某工厂排除出的废水中含有少量的Zn2+、Ag+、Na+SO42-及一些悬浮的泥沙等不溶物.
请你设计一个既经济又合理的方法回收Ag和ZnSO4·7H2O晶体,要求按先后次序列出实验步骤,并说明第一个步骤的实验目的(不必写化学方程式,也不必对回收的Ag和ZnSO4·7H2O进行洗涤干燥).
(1)___________________
(2)___________________
(3)___________________
(4)___________________
(5)___________________
(6)___________________.
注:上面的空不一定要填完,不够也可以补.
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2011-2012学年新疆奎屯市农七师高中高二上学期期末考试化学试卷 题型:实验题
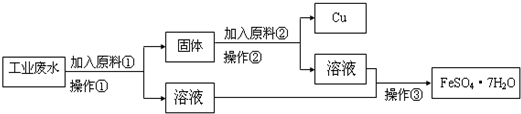
(8分)某工厂排出的废水中含有大量的Fe2+、Cu2+和SO 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。
查看答案和解析>>
科目:高中化学 来源:2013届新疆奎屯市高二上学期期末考试化学试卷 题型:实验题
(8分)某工厂排出的废水中含有大量的Fe2+、Cu2+和SO 。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。

请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com