
【题目】下列说法正确的是
A. H2(g)+I2(g) ![]() 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B. 若压强不再随时间变化能说明反应A(?)+B(g)![]() 2C(?)已达平衡,则A、C不能同时是气体
2C(?)已达平衡,则A、C不能同时是气体
C. C(s)+H2O(g) ![]() H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
D. 2NO2 ![]() N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
【答案】B
【解析】
A. 压强越大,有气体参加或生成的可逆反应正逆反应速率都增大,缩小容器体积相当于增大压强,增大单位体积内活化分子个数,正逆反应速率都增大,A项错误;
B. 如果A. C都是气体,该反应是气体分子数不变的体系,压强每个时刻都不发生改变,则不能说明该反应达到平衡状态,所以A. C不能同时都是气体,B项正确;
C. C(s)+H2O(g) ![]() H2(g)+CO中,在未达到平衡前,碳的质量不断变化,当达到平衡时,碳的质量不变,则碳的质量不再改变能说明反应已达平衡,C项错误;
H2(g)+CO中,在未达到平衡前,碳的质量不断变化,当达到平衡时,碳的质量不变,则碳的质量不再改变能说明反应已达平衡,C项错误;
D. 2NO2 ![]() N2O4(无色),体系颜色不再变化说明反应已达动态平衡,但反应不会停止,D项错误;
N2O4(无色),体系颜色不再变化说明反应已达动态平衡,但反应不会停止,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】某化学反应其△H=-122 kJ/mol,S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行B.在任何温度下都不能自发进行
C.仅在高温下自发进行D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,能达到实验目的的是
A.  验证酸性HCl > H2SiO3
验证酸性HCl > H2SiO3
B. 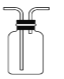 收集 HCl或 CO
收集 HCl或 CO
C. 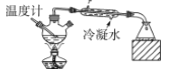 分离沸点不同且互溶的液体混合物
分离沸点不同且互溶的液体混合物
D. ![]() 分离酒精和水
分离酒精和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。

(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、________________、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。②铜与浓硫酸反应的化学方程式是________________,装置A中试剂是_______。③能说明碳的非金属性比硅强的实验现象是_______________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是____________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应的位置______。

写出其中SO2显示还原性生成沉淀的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
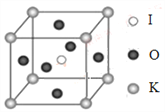
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
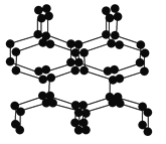
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均为气体,对于A+3B![]() 2C +D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
2C +D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
A. v(A)=0.4mol/(Ls)B. v(B)=0.8mol/(Ls)
C. v(C)=0.6mol/(Ls)D. v(D)=0.5mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一氧化碳与水蒸气的反应为:CO(g)+H2O (g)![]() CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
CO2 (g)+H2 (g),在427℃时的平衡常数是9.4。回答下列问题:
(1)氢气作为燃料与汽油相比,其优点是____________________________________________(答一条即可)。
(2)800℃时,在容积为2.0L的密闭容器中充入2.0mlCO(g)和3.0molH2O(g),保持温度不变,4min后
反应达到平衡,测得CO的转化率为60%。
①4min内H2的平均化学反应速率为__________mol/(L·min)。
②800℃时该反应的平衡常数值为__________。请结合题中的信息判断该反应的△H__________0。
(3)一定条件下,设起始加入二氧化碳和氢气且![]() = Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)
= Z,在恒压下.平衡时CO2的体积分数φ(CO2) 与Z和T(温度)的关系如图所示,下列说法正确的是(_____)

A.该反应的焓变△H>0
B.图中Z的大小为b>3>a
C.图中x 点对应的平衡混合物中![]() = 3
= 3
D.温度不变时,图中x点对应的平衡在加压后φ(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是( )
①2v(NH3)=v(CO2)②密闭容器中总压强不变③密闭容器中混合气体的密度不变④密闭容器中氨气的体积分数不变
A. ①② B. ②③ C. ②④ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com