
| 实验方案 | 实验现象 | 有关化学方程式 |
| 用砂纸擦后的镁条、铝条分别投入到盛有沸水的小烧杯中,再分别滴加酚酞 | 投入镁条的试管有大量气泡产生,滴加酚酞后溶液变成浅红色;投入铝条的试管中无明显现象. | Mg+2H2O Mg(OH)2+H2↑ Mg(OH)2+H2↑ |
| 将一绿豆粒大小的钠投入到盛有冷水且预先滴有酚酞的小烧杯中 | 钠浮于水面上,迅速熔成闪亮小球四处游动,有响声,随之消失,溶液很快变红色 | 2Na+2H2O═2NaOH+H2↑ |
| 用玻璃棒分别蘸取0.1mol/L的Na2SiO3(aq)、 Na3PO4(aq)、Na2SO4(aq)测其pH | Na2SiO3(aq)的pH比Na3PO4(aq)的pH大且都大于7;Na2SO4(aq)的pH为7(中性) | SiO32-+2H2O H2SiO3+2OH-; H2SiO3+2OH-;PO43-+H2O  HPO42-+OH- HPO42-+OH- |
| 用滴管向盛有5mL饱和氢硫酸溶液的试管中滴加饱和的氯水 | 试管中有淡黄色沉淀生成 | Cl2+H2S═2HCl+S↓ |


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 微热 |

| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源:2004全国各省市高考模拟试题汇编·化学 题型:058
如图中A、B、C是常见的化学实验装置,请回答下列问题:
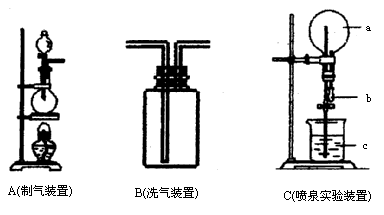
(1)利用A装置,当不加热时,可制取的一种气态单质是________;当加热时,可制取的一种化合物是________.
(2)化学实验室用A装置加热制取氯气,化学方程式为:
________.
为得到纯净、干燥的氯气,可让A中出来的气体在进入收集装置前依次通过分别装有________和________的两个洗气瓶B.
(3)实验室制取氯气和二氧化碳都可用瓶口向上排空集气法收集,具体操作有何不同?为什么?
________
(4)有一烧瓶纯净、干燥的氯气,用装置C做喷泉实验,如何操作才能形成喷泉?
________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com